
Contador de células
En el contador de células: Células HT1080
La línea celular de fibrosarcoma HT1080 se generó en 1972 a partir de tejido de biopsia tumoral. Curiosamente, el paciente no había recibido tratamiento con radiación ni quimioterapia en el momento de la biopsia, por lo que las células carecen del tipo de mutaciones no deseadas que se encuentran normalmente debido a estos tratamientos. Puesto que las células HT1080 son muy invasivas, a menudo se utilizan como modelo de invasión y migración celular. Los investigadores han podido identificar una serie de posibles fármacos para el cáncer en función de su capacidad para inhibir el comportamiento invasivo de las células HT1080.
Ver el seminario web de detección de células StainFree
Descargar la nota de aplicación de detección de células StainFree
Descargar eBook: Realice recuentos de células de forma profesional
Figura 1: Adquisición de imágenes de migración celular
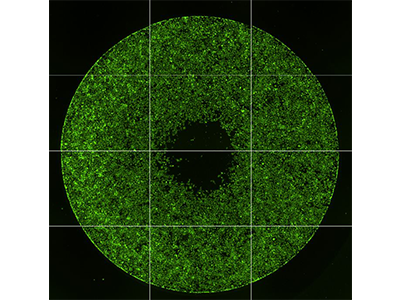
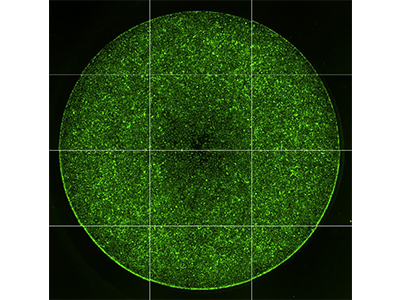
Se utilizó el ensayo de migración celular Oris™ Pro de Platypus Technologies para medir la migración de las células HT1080 tratadas con citocalasina D (izquierda) o DMSO control (derecha). Este ensayo utiliza un gel biocompatible (GBC) no tóxico para formar una zona sin células en superficies del cultivo. Tras sembrar las células en la placa de 96 pocillos, el GBC se disuelve, permitiendo que las células migren al centro del pocillo (área indicada mediante círculos amarillos). Se obtuvieron imágenes de los resultados en el citómetro con adquisición de imágenes SpectraMax MiniMax 300 y se contaron las células que habían migrado al centro del pocillo usando la función de selección de la región de interés (ROI) en el software SoftMax Pro.
Figura 2: Recuentos celulares StainFree
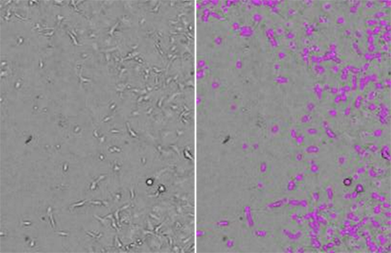
Se adquirieron imágenes de las células HT1080 con el citómetro con adquisición de imágenes SpectraMax MiniMax 300 y las células se identificaron utilizando la configuración de análisis “CellsD” (Células D) predefinida. A la izquierda se muestra la imagen original con luz transmitida y a la derecha, la misma imagen con máscaras púrpura que indican las células identificadas por el software.
Figura 3: Cuantificación de la migración celular
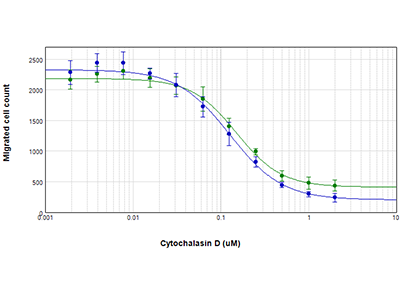
Las células se trataron con citocalasina D y se contaron aquellas que posteriormente migraron al centro del pocillo utilizando la tecnología StainFree (círculos azules) o análisis de células fluorescentes (círculos verdes). Los valores de EC50 para la citocalasina D fueron 0,13 µM y 0,15 µM, respectivamente, lo que confirma que no es necesario teñir las células para evaluar con exactitud la migración celular con el ensayo Oris Pro.
Kit de herramientas de análisis de células HT1080
- Plataforma de detección de microplacas multimodo SpectraMax® i3
- Citómetro con adquisición de imágenes SpectraMax® MiniMax™ 300
- Software SoftMax® Pro
Configuración del instrumento
Tipo de análisis: “Discrete Object Analysis” (Análisis de objetos definidos)
Longitud de onda para la búsqueda de objetos: LT
Acerca de la tecnología de detección de células StainFree
Los ensayos basados en la adquisición de imágenes celulares normalmente requieren el uso de sondas fluorescentes que pueden ser tóxicas o funcionar únicamente en células fijadas. Un método sin marcaje para analizar recuentos celulares y la confluencia celular permite a los investigadores monitorizar cuantitativamente la proliferación celular y la salud de las células sin necesidad de flujos de trabajo laborioso que pueden alterar la viabilidad celular.
La plataforma de microplacas multimodo SpectraMax i3 con el citómetro con adquisición de imágenes MiniMax 300 utiliza la exclusiva tecnología de detección de células StainFree pendiente de patente que le permite realizar ensayos de proliferación celular, citotoxicidad y otros ensayos sin tinciones nucleares como DAPI, que se intercala en el ADN, o colorantes de células vivas que son realmente tóxicos para las células a largo plazo.