
Contador de células
En el contador de células: Células PC-12
Las células PC-12, cultivadas en primer lugar por Greene y Tischler en 1976, se originaron a partir de un feocromocitoma (tumor neuroendocrino) de médula suprarrenal de rata. Se desarrolló como línea celular modelo y una alternativa a los cultivos de células cromafines suprarrenales primarias. Las células PC-12 se pueden diferenciar en células similares a neuronas en presencia de factor de crecimiento nervioso o dexametasona. Gracias a su capacidad para diferenciación y a su facilidad de cultivo, las células PC-12 se utilizan en diversas áreas de investigación que abarcan desde la eficacia de fármacos a la neurosecreción.
Ver el seminario web de detección de células StainFree
Descargar la nota de aplicación de detección de células StainFree
Descargar eBook: Realice recuentos de células de forma profesional
Figura 1. Tecnología StainFree comparada con el recuento de células con fluorescencia
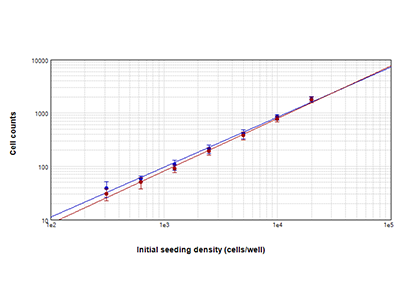
Recuento de células PC-12 usando la tecnología de detección celular StainFree™ (círculos azules) y tinción nuclear roja (círculos rojos). Los recuentos obtenidos con ambos métodos coinciden bastante, lo que demuestra que la tecnología StainFree proporciona recuentos celulares exactos, eliminando a la vez la necesidad de colorantes fluorescentes (r2 > 0,99 para cada representación).
Figura 2. Curvas de crecimiento obtenidas utilizando el análisis de áreas cubiertas StainFree
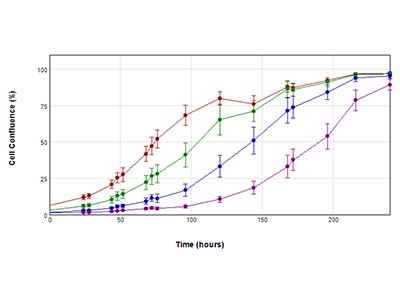
Curvas de crecimiento de las células PC-12 durante un periodo de diez días. Las células se sembraron originalmente a 2000 células (rojo), 1000 células (verde), 500 células (azul) y 200 células (púrpura) por pocillo. La confluencia de las células se midió cada 24 horas usando la función “Field Analysis” (Análisis de campo) del software SoftMax Pro. El descenso observado en la confluencia en la población de densidad inicial de 2000 células a las 144 horas (*) se debe probablemente al agotamiento de nutrientes en el medio de cultivo; el medio se cambiaba originalmente cada tres días, pero a partir de las 144 horas en adelante se sustituyó diariamente.
Figura 3. Análisis StainFree de células PC-12 con tinción mitocondrial
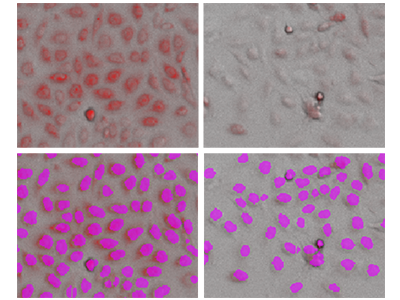
En la fila superior se muestran las imágenes con luz transmitida superpuesta con las imágenes fluorescentes rojas (mitocondrias). En la fila inferior se muestra el análisis StainFree con las células individuales (máscaras púrpura) identificadas por el software. Izquierda, células no tratadas; derecha, células tratadas con 1 µM de valinomicina. Se puede calcular la intensidad de la tinción mitocondrial de cada célula individual identificada.
Figura 4. Curvas de IC50 de las células PC-12 tratadas con valinomicina
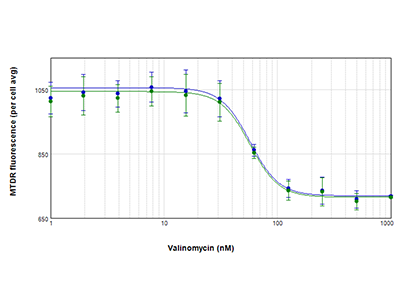
Las células PC-12 se trataron con valinomicina y se analizó la actividad mitocondrial utilizando el colorante MitoTracker™ Deep Red FM (MTDR). Se muestran las curvas de respuesta dependiente de concentración de las células analizadas con la tecnología StainFree (azul) o la tinción nuclear fluorescente (verde) para identificar las células individuales. Se representa la media de fluorescencia mitocondrial por célula frente a la concentración de valinomicina. Se obtuvieron curvas prácticamente idénticas con ambos métodos de análisis y, en ambos casos, el valor de IC50 era 57 nM.
Consejo 1:
Para contar las células PC-12 sin tinción, recomendamos crear una configuración nueva usando las herramientas de dibujo del software. Elija el “Discrete Object Analysis” (Análisis de objetos definidos) y luego utilice las herramientas de dibujo para definir células y áreas sin células en las imágenes máx. y mín. Para conseguir recuentos más exactos en agregados densos de células, intente dibujar justo dentro de los bordes de las células. Por el contrario, si encuentra que el software está realizando un recuento excesivo de las células en las imágenes, intente dibujar ligeramente por fuera de los bordes de las células.
Consejo2:
Es fácil conseguir curvas de crecimiento con la función “Field Analysis” (Análisis de campo) del software SoftMax Pro. El análisis de campo calcula el porcentaje de área cubierta por células (confluencia) en sus imágenes. La medición de la confluencia celular puede ser una herramienta valiosa para un mejor desarrollo de ensayos. Por ejemplo, puede sembrar células a dos o más densidades, calcular la confluencia de las células justo antes del ensayo y, tras obtener los resultados del ensayo, determinar qué nivel de confluencia proporciona los mejores resultados.
Kit de herramientas de análisis de células PC-12
- Plataforma de detección de microplacas multimodo SpectraMax® i3
- Citómetro con adquisición de imágenes SpectraMax® MiniMax™ 300
- Software SoftMax® Pro
Configuración del instrumento
Acerca de la tecnología de detección de células StainFree
Los ensayos basados en la adquisición de imágenes celulares normalmente requieren el uso de sondas fluorescentes que pueden ser tóxicas o funcionar únicamente en células fijadas. Un método sin marcaje para analizar recuentos celulares y la confluencia celular permite a los investigadores monitorizar cuantitativamente la proliferación celular y la salud de las células sin necesidad de flujos de trabajo laborioso que pueden alterar la viabilidad celular.
La plataforma de microplacas multimodo SpectraMax i3 con el citómetro con adquisición de imágenes MiniMax 300 utiliza la exclusiva tecnología de detección de células StainFree pendiente de patente que le permite realizar ensayos de proliferación celular, citotoxicidad y otros ensayos sin tinciones nucleares como DAPI, que se intercala en el ADN, o colorantes de células vivas que son realmente tóxicos para las células a largo plazo.