
Contador de células
En el contador de células: Células U937
Las células U937 se aislaron a partir de un linfoma histiocítico de un paciente de 37 años en 1974. Puesto que son una de las pocas líneas celulares disponibles que expresan muchas características monocíticas, se utilizan a menudo para estudiar el comportamiento y la diferenciación de los monocitos. Las células U937 sufren apoptosis cuando se tratan con factor estimulante de colonias de granulocitos y macrófagos (GM-CSF; Okuma et al., 2000), lo que las convierte en un modelo útil para estudios de señalización celular apoptótica.
Ver el seminario web de detección de células StainFree
Descargar la nota de aplicación de detección de células StainFree
Descargar eBook: Realice recuentos de células de forma profesional
Figura 1: Imágenes obtenidas con el citómetro SpectraMax MiniMax

Las células U937 se identificaron utilizando la configuración de análisis predefinida “CellsC” (Células C) en el software SoftMax Pro. Izquierda, imagen con luz transmitida; derecha, análisis StainFree con máscaras púrpura que indican las células identificadas por el software.
Figura 2: Recuentos celulares con StainFree frente a recuentos celulares con fluorescencia
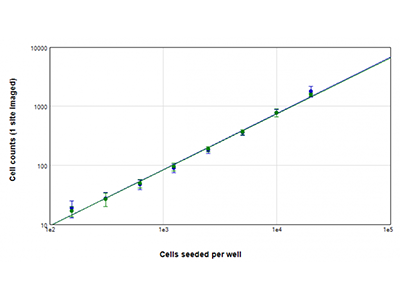
Las células U937 se sembraron a densidades que oscilaban de 156 a 20 000 células por pocillo y los núcleos se tiñeron con colorante EarlyTox™ Live Green. Las imágenes se adquirieron en un único sitio por pocillo. A continuación se hizo un recuento de las células de cada imagen utilizando el método StainFree (línea azul) o haciendo un recuento de núcleos fluorescentes verdes (línea verde).
Figura 3: Ensayo EarlyTox Live/Dead
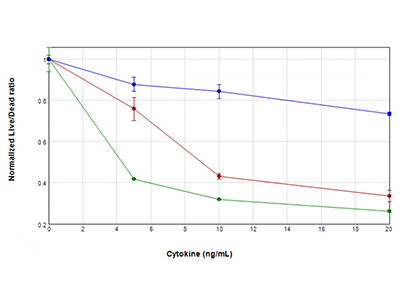
Las células U937 se trataron con concentraciones de GM-CSF (línea azul), TNFα (línea roja) o TNFα más GM-CSF (línea verde) que oscilaban de 0 ng/ml a 20 mg/ml, durante 48 horas. A continuación se analizó su viabilidad con el kit de ensayo EarlyTox™ Live/Dead. La fluorescencia se detectó con el lector de microplacas multimodo SpectraMax i3x. Se representó la relación de la señal de fluorescencia de células vivas/muertas frente a la concentración de citoquinas, lo que revela una pérdida de viabilidad celular en las células tratadas que es especialmente importante cuando se combinan TNFα y GM-CSF.
Figura 4: Ensayo EarlyTox Caspase-3/7 R110
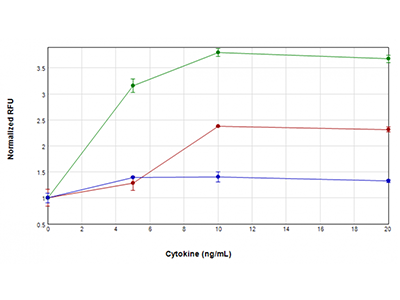
Las células U937 se trataron con concentraciones de TNFα más GM-CSF (línea verde), TNFα (línea roja) o GM-CSF solo (línea azul) que oscilaban de 0 ng/ml a 20 mg/ml, durante 48 horas. A continuación se analizó la actividad caspasa-3/7 usando el ensayo EarlyTox™ Caspase-3/7 R110. La señal fluorescente indicativa de actividad caspasa se detectó con el lector SpectraMax i3x. La actividad caspasa más alta se observó cuando las células se trataron con TNFα más GM-CSF, lo que sugiere una activación sinérgica de la caspasa.
Figura 5: Ensayo EarlyTox Caspase-3/7 NucView 488
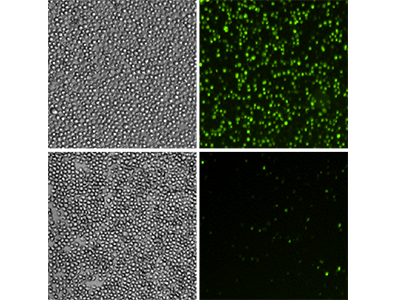
Las células U937 se trataron con 10 ng/ml de TNFα y GM-CSF (fila superior) o se dejaron sin tratar (fila inferior) durante 48 horas. Posteriormente se analizaron con el ensayo EarlyTox™ Caspase-3/7 NucView™ 488. La tinción fluorescente verde identificó las células con caspasa-3/7 activa. Paneles izquierdos, imágenes de las células con luz transmitida; paneles derechos, imágenes de fluorescencia verde que revelan las células con caspasa-3/7 activa.
Consejo:
Las células U937 crecen en suspensión y tienen forma redondeada que facilita su recuento. Para el recuento StainFree, utilice simplemente la configuración de análisis predefinida “CellsC” (Células C) en el menú desplegable del software SoftMax Pro para analizar las imágenes de las células con un solo clic.
Kit de herramientas de análisis de células U937
- Plataforma de detección de microplacas multimodo SpectraMax® i3
- Citómetro con adquisición de imágenes SpectraMax® MiniMax™ 300
- Software SoftMax® Pro
Luz transmitida (LT)
541 nm (fluorescencia verde)
Exposición a LT: 7 ms
Ajuste del foco de LT: -5 µm
Exposición 541: 1 ms
Ajuste del foco de 541: 40 µm
Tipo de análisis: “Discrete Object Analysis” (Análisis de objetos definidos)
Longitud de onda para la búsqueda de objetos: LT (StainFree) o 541 (núcleos verdes)
LT: “CellsC” (Células C) (predefinida)
541: Definir tamaño e intensidad: Tamaño = 10-30 µm, Intensidad por encima del fondo = 150
Acerca de la tecnología de detección de células StainFree
Los ensayos basados en la adquisición de imágenes celulares normalmente requieren el uso de sondas fluorescentes que pueden ser tóxicas o funcionar únicamente en células fijadas. Un método sin marcaje para analizar recuentos celulares y la confluencia celular permite a los investigadores monitorizar cuantitativamente la proliferación celular y la salud de las células sin necesidad de flujos de trabajo laborioso que pueden alterar la viabilidad celular.
La plataforma de microplaca multimodo SpectraMax i3/i3x con el citómetro con adquisición de imágenes MiniMax 300 utiliza la exclusiva tecnología de detección de células StainFree pendiente de patente que le permite realizar ensayos de proliferación celular, citotoxicidad y otros ensayos sin tinciones nucleares como DAPI, que se intercala en el ADN, o colorantes de células vivas que son realmente tóxicos para las células a largo plazo.