
Contador de células
En el contador de células: Células HeLa
Las células HeLa fueron la primera línea celular que se creció en el laboratorio y que aún hoy día se sigue utilizando en innumerables proyectos de investigación biomédica. Se obtuvieron a partir de un cáncer de cuello uterino en 1951 de Henrietta Lacks, una paciente que posteriormente falleció debido a la enfermedad. En el bestseller de Rebecca Skloot “La vida inmortal de Henrietta Lacks” se relata la fascinante historia de su vida y su legado.
Ver el seminario web de detección de células StainFree
Descargar la nota de aplicación de detección de células StainFree
Descargar eBook: Realice recuentos de células de forma profesional
Figura 1. Análisis StainFree comparado con el recuento de células con fluorescencia
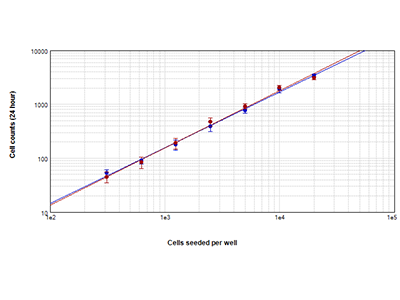
Recuento de células HeLa usando la tecnología de detección celular StainFree™ (círculos azules) y tinción nuclear roja (círculos rojos). Los recuentos obtenidos con ambos métodos coinciden bastante, lo que demuestra que la tecnología StainFree proporciona recuentos celulares exactos, eliminando a la vez la necesidad de colorantes fluorescentes (r > 0,99 para cada representación).
Figura 2. Curvas de crecimiento obtenidas utilizando el análisis de áreas cubiertas StainFree
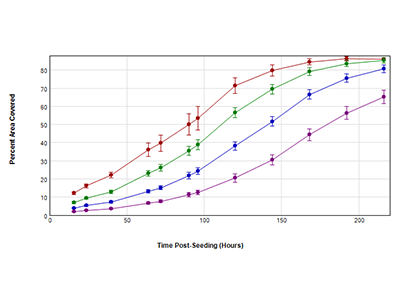
Las células HeLa se sembraron a 4 densidades iniciales en una placa de 96 pocillos: 250 (púrpura), 500 (azul), 1000 (verde) y 2000 (rojo) células por pocillo. Se tomaron imágenes de las células con el canal de luz transmitida (LT) durante 9 días. Se determinó el porcentaje de área cubierta por las células en cada punto temporal con el análisis StainFree.
Figura 3. Citotoxicidad medida usando la tecnología StainFree
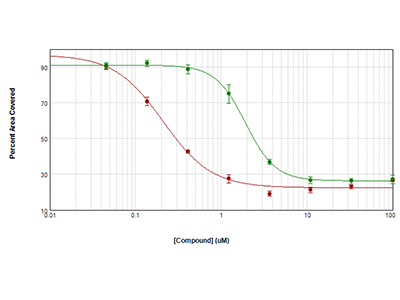
Las células HeLa se sembraron a 1000 células por pocillo y se dejaron crecer durante toda la noche. A continuación, se trataron con anisomicina (círculos rojos) o tricostatina (círculos verdes) durante 72 horas. La citotoxicidad se midió calculando el porcentaje de área cubierta con el análisis StainFree. Las curvas de IC50 se representaron con el software Software Pro.
Figura 4. Imágenes de células HeLa tratadas con compuestos tóxicos

Fila superior: Las células HeLa se trataron con concentraciones bajas (izquierda) o altas (derecha) de anisomicina y se obtuvieron imágenes con el canal de luz transmitida (LT). Fila inferior: Las células HeLa se trataron con concentraciones bajas (izquierda) o altas (derecha) de estaurosporina y los ensayos de citotoxicidad se realizaron con el kit EarlyTox Cell Integrity. Las células vivas están marcadas en rojo y las células muertas en rojo y verde.
Consejo 1:
Para contar las células HeLa sin tinción, utilice la configuración predefinida “CellsA” (Células A) en el software SoftMax Pro o cree una nueva configuración usando las herramientas de dibujo del software. El método de análisis que utilice dependerá de la morfología y las condiciones de crecimiento de sus células. Inténtelo primero con la configuración predefinida y compruebe cómo se ve.
Consejo2:
La obtención de curvas de crecimiento como las que se ven aquí se simplifica con la función “Field Analysis” (Análisis de campo) del software SoftMax Pro. El análisis de campo calcula el porcentaje de área cubierta por células (confluencia) en sus imágenes. El cálculo de la confluencia celular también puede ser útil para el desarrollo de ensayos. Por ejemplo, puede realizar ensayos con sus células a diferentes densidades y determinar qué densidad proporciona mejores resultados.
Consejo3:
La monitorización de la citotoxicidad a lo largo del tiempo es fácil. Simplemente, analice el porcentaje de área cubierta por las células en los puntos temporales deseados y represente los resultados en el software SoftMax Pro. No es necesario teñir ni recoger las células.
Kit de herramientas de análisis de células HeLa
- Plataforma de detección de microplacas multimodo SpectraMax® i3
- Citómetro con adquisición de imágenes SpectraMax® MiniMax™ 300
- Software SoftMax® Pro
- Kit EarlyTox™ Cell Integrity
Configuración del instrumento
Tipo de análisis: “Discrete Object Analysis” (Análisis de objetos definidos)
Longitud de onda para la búsqueda de objetos: LT
Acerca de la tecnología de detección de células StainFree
Los ensayos basados en la adquisición de imágenes celulares normalmente requieren el uso de sondas fluorescentes que pueden ser tóxicas o funcionar únicamente en células fijadas. Un método sin marcaje para analizar recuentos celulares y la confluencia celular permite a los investigadores monitorizar cuantitativamente la proliferación celular y la salud de las células sin necesidad de flujos de trabajo laborioso que pueden alterar la viabilidad celular.
La plataforma de microplacas multimodo SpectraMax i3 con el citómetro con adquisición de imágenes MiniMax 300 utiliza la exclusiva tecnología de detección de células StainFree pendiente de patente que le permite realizar ensayos de proliferación celular, citotoxicidad y otros ensayos sin tinciones nucleares como DAPI, que se intercala en el ADN, o colorantes de células vivas que son realmente tóxicos para las células a largo plazo.