
Contador de células
En el contador de células: Células RBL
El establecimiento de las líneas celulares de leucemia basofílica de rata (RBL) en los años 70 del siglo pasado ofreció a los investigadores un sistema modelo cómodo, aunque imperfecto, para el estudio de mastocitos difíciles de obtener. Las células RBL-2H3 subclonadas a partir de una de las líneas celulares RBL originales se han utilizado para el estudio de las vías bioquímicas de secreción en mastocitos. Algunas líneas celulares RBL crecen como cultivos en suspensión y otras son adherentes. Puesto que la morfología de las células en diferentes condiciones de crecimiento, o incluso en el mismo cultivo, puede variar, la posibilidad de crear una configuración de análisis StainFree personalizada es extremadamente útil para garantizar recuentos celulares exactos.
Ver el seminario web de detección de células StainFree
Descargar la nota de aplicación de detección de células StainFree
Descargar eBook: Realice recuentos de células de forma profesional
Figura 1: Recuentos celulares StainFree
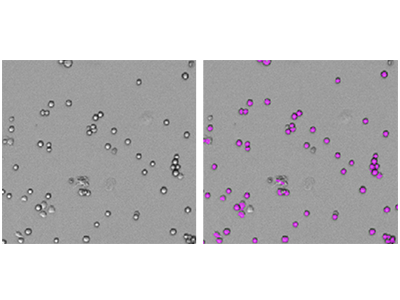
Se adquirieron imágenes de las células RBL-1 con el citómetro con adquisición de imágenes SpectraMax i3x MiniMax 300 y las células se identificaron utilizando una configuración de análisis personalizada, definida por el usuario. A la izquierda se muestra la imagen original con luz transmitida y a la derecha, la misma imagen con máscaras púrpura que indican las células identificadas por el software.
Figura 2: Recuentos celulares StainFree frente a recuentos nucleares con fluorescencia
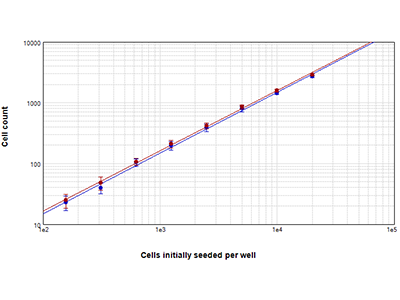
Las células RBL-1 sembradas a densidades que oscilaban de 156 a 20 000 células por pocillo se contaron con la tecnología StainFree (puntos azules) o se tiñeron con el colorante EarlyTox™ Live Red y se contaron los núcleos fluorescentes rojos (puntos rojos). Los recuentos celulares obtenidos con ambos métodos coincidían bastante en el rango completo de densidades celulares. Los recuentos celulares se midieron dentro de una región de interés (ROI) definida por el usuario.
Figura 3: Ensayo FLIPR Calcium 6 en el lector de microplacas multimodo FlexStation 3
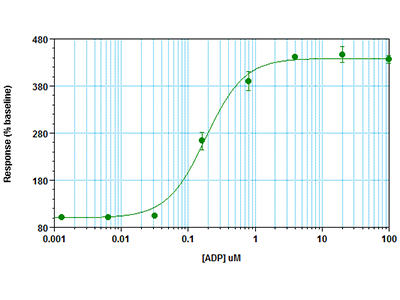
Las células RBL-2H3 se sembraron a 30 000 células por pocillo en una placa de 96 pocillos y se incubaron durante toda la noche. Al día siguiente, se retiró el medio de cultivo y se añadió a los pocillos el colorante de ensayo FLIPR® Calcium 6 más probenecid y se incubaron las células durante 2 horas. A continuación se realizó un ensayo cinético con fluorescencia en el lector de microplacas multimodo FlexStation® 3. El pipeteador integrado dispensó el agonista de ADP a los pocillos del ensayo y se midió simultáneamente con el lector de placas la señal fluorescente indicativa de la movilización del calcio del fondo de los pocillos.
Figura 4: Ensayo Fura-2 QBT Calcium en el lector de microplacas multimodo FlexStation 3
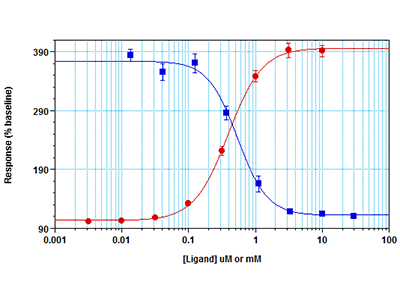
Las células RBL-2H3 se sembraron a 30 000 células por pocillo en una placa de 96 pocillos y se incubaron durante toda la noche. Al día siguiente se añadió el colorante Fura-2 QBT™ durante 60 minutos, después de retirar el medio de crecimiento. Para los estudios de IC50, se añadió a las células el inhibidor YM-58483 durante 45 minutos antes del ensayo. A continuación se realizó un ensayo cinético con fluorescencia en el lector de microplacas multimodo FlexStation 3. El pipeteador integrado dispensó CaCl2 a los pocillos a la concentración de EC80 (para el ensayo de inhibición, puntos azules) o en una serie de titulación (puntos rojos). Se midió simultáneamente con el lector de placas la señal fluorescente indicativa de la movilización del calcio del fondo de los pocillos.
Consejo:
Puesto que a menudo hay algunas células adherentes presentes en los cultivos en suspensión de células RBL, puede ser muy útil una configuración de análisis creada por el usuario para “entrenar” al software en la identificación únicamente de las células con morfología de tipo en suspensión y excluir a las células adheridas. En el caso de cultivos adherentes, que pueden variar en morfología, una configuración de análisis creada por el usuario maximiza la identificación de todas las células, independientemente de su forma.
Kit de herramientas de análisis de células RBL
- Plataforma de detección de microplacas multimodo SpectraMax® i3
- Citómetro con adquisición de imágenes SpectraMax® MiniMax™ 300
- Software SoftMax® Pro
Configuración del instrumento para la adquisición de imágenes y recuento de células
Exposición: 7 ms
Ajuste del foco de: 20 µm
Tipo de análisis: “Discrete Object Analysis” (Análisis de objetos definidos)
Longitud de onda para la búsqueda de objetos: LT
Acerca de la tecnología de detección de células StainFree
Los ensayos basados en la adquisición de imágenes celulares normalmente requieren el uso de sondas fluorescentes que pueden ser tóxicas o funcionar únicamente en células fijadas. Un método sin marcaje para analizar recuentos celulares y la confluencia celular permite a los investigadores monitorizar cuantitativamente la proliferación celular y la salud de las células sin necesidad de flujos de trabajo laborioso que pueden alterar la viabilidad celular.
La plataforma de microplacas multimodo SpectraMax i3 con el citómetro con adquisición de imágenes MiniMax 300 utiliza la exclusiva tecnología de detección de células StainFree pendiente de patente que le permite realizar ensayos de proliferación celular, citotoxicidad y otros ensayos sin tinciones nucleares como DAPI, que se intercala en el ADN, o colorantes de células vivas que son realmente tóxicos para las células a largo plazo.