Descripción general de TRF/TR-FRET (HTRF)
Fluorescencia resuelta en el tiempo (Time-Resolved Fluorescence, TRF)
Las mediciones de la intensidad de fluorescencia (IF) utilizan fluoróforos convencionales, como la fluoresceína, cuya emisión es de corta duración (del orden de nanosegundos). La excitación de la muestra y la medición de la emisión ocurren de forma simultánea. Aunque los lectores de microplacas tienen una gran capacidad para separar la luz de excitación de la medición de la emisión, esa luz de excitación, junto con la luz de corta duración emitida por los materiales del pocillo o la muestra, contribuye a menudo a que el fondo sea elevado.
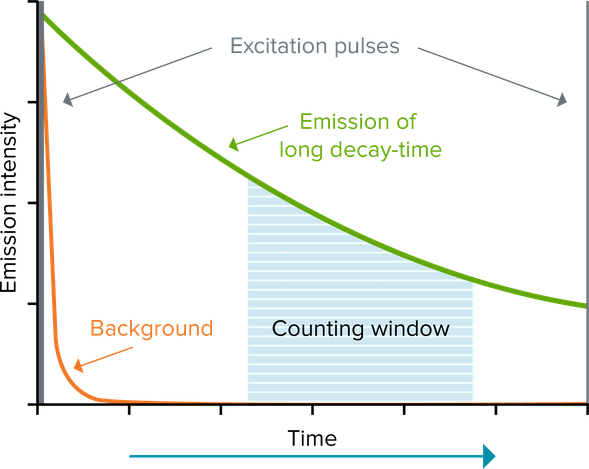
La fluorescencia resuelta en el tiempo (TRF) reduce el fondo mediante un fluoróforo lantánido, como el europio o el terbio, que emite fluorescencia de larga duración. Esta fluorescencia de larga duración se prolonga varios milisegundos, por lo que la excitación del fluoróforo a través de una fuente de luz pulsada (p. ej., una lámpara de flash), seguida de una demora y, posteriormente, de la medición de la señal (“ventana de recuento”), permite que la fluorescencia de corta duración (con una duración de tan solo nanosegundos) desaparezca antes de realizar la medición. En los ensayos que utilizan fluorescencia resuelta en el tiempo, la relación señal/ruido aumenta considerablemente. Los lantánidos utilizados con más frecuencia son europio, terbio y samario. Estos se utilizan habitualmente en forma de complejos de quelato o criptato que ofrecen una intensidad y una estabilidad de la señal adecuadas.
Transferencia de energía de resonancia de fluorescencia resuelta en el tiempo (Time-Resolved Fluorescence Resonance Energy Transfer, TR-FRET)

no FRET FRET
El donador y el aceptor están alejados El donador y el aceptor están muy próximos
La TR-FRET combina la medición resuelta en el tiempo (TR) de la fluorescencia con la tecnología de transferencia de energía de resonancia de fluorescencia (FRET). En los ensayos con FRET, las biomoléculas (p. ej., proteínas) se marcan con fluoróforos donador y aceptor. Cuando las biomoléculas interactúan, los fluoróforos donador y aceptor se aproximan. De este modo, cuando el donador se excita, puede transferir su energía de emisión al aceptor, que a su vez emite fluorescencia a una longitud de onda específica. Las emisiones de fluorescencia del donador y del aceptor tienen longitudes de onda diferentes que pueden diferenciarse entre sí con un lector de microplacas, lo que permite la cuantificación de la interacción biomolecular.
Al utilizar como donadores fluoróforos lantánidos, que tienen una emisión de fluorescencia de larga duración, los ensayos con TR-FRET emplean la medición resuelta en el tiempo de la fluorescencia para eliminar la fluorescencia de fondo de corta duración. Gracias a la emisión de larga duración del fluoróforo donador, en un ensayo con TR-FRET, la excitación y la emisión de los fluoróforos donador y aceptor pueden medirse también después de reducir la fluorescencia de fondo de corta duración.
Fluorescencia homogénea resuelta en el tiempo (HTRF)
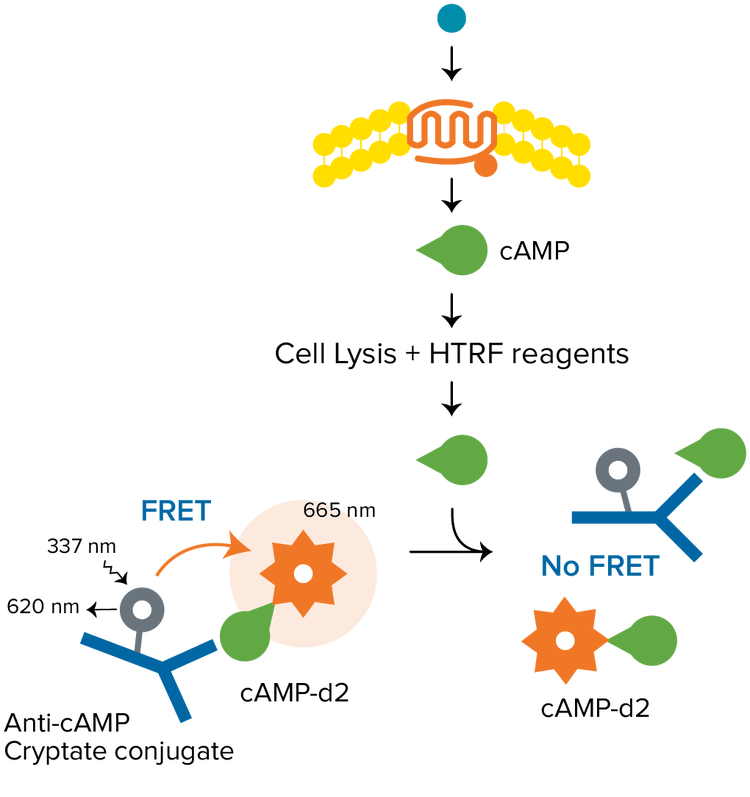
HTRF es una tecnología TR-FRET versátil desarrollada por Cisbio para la detección de interacciones biomoleculares. En un ensayo típico de HTRF se utiliza un criptato de europio como donador y el fluoróforo d2 orgánico como aceptor. El donador y el aceptor se pueden usar para marcar diferentes biomoléculas, para aplicaciones que incluyan epigenética, cuantificación de biomarcadores, señalización de GPCR, y mucho más. Los ensayos con HTRF requieren un lector de microplacas con modo de detección TRF que sea compatible con HTRF certificada por Cisbio.
Ventajas y consideraciones
Una ventaja clave de la detección de TRF y TR-FRET es el reducido fondo y la mayor relación señal-ruido en comparación con la fluorescencia convencional, lo que tiene como resultado una mayor sensibilidad. Además, el ensayo tiene un sólido formato de “mezclar y leer” que no requiere lavados. Esto, junto con la estabilidad del ensayo, facilita la automatización y miniaturización para aplicaciones de cribado.
Aplicaciones y ensayos
Los ensayos con TRF y TR-FRET (HTRF) permiten el análisis de interacciones moleculares en procesos bioquímicos y son muy utilizados para estudios con ensayos de quinasas, vías de señalización celular, interacciones proteína-proteína, interacciones ADN-proteína, citotoxicidad celular y unión receptor-ligando.
En la tabla de la derecha se indican ejemplos de ensayos para TR-FRET, junto con varios recursos de fluorescencia resuelta en el tiempo a continuación.