7 consejos para optimizar su flujo de trabajo de adquisición y análisis de imágenes de células 3D
A medida que el campo de la biología celular avanza hacia una mayor complejidad de los ensayos, los sistemas celulares 3D han demostrado proporcionar información más relevante desde el punto de vista fisiológico en comparación con los ensayos 2D tradicionales para el descubrimiento de fármacos y el modelo de enfermedades. En los sistemas 2D tradicionales, las células se estiran, adhieren y crecen sobre una superficie plana, mientras que los sistemas 3D imitan mejor el entorno tisular in vivo a través de interacciones célula-célula/ECM, penetración del compuesto y respuesta a la dosis.
Con una mayor complejidad de los ensayos 3D, surgen nuevos problemas relacionados con la captura de imágenes celulares, como tiempos de adquisición y análisis de imágenes más largos, así como mayores requisitos de almacenamiento de datos. Mediante el uso de las herramientas y técnicas adecuadas, puede superar estos problemas y obtener datos fiables de una manera más eficiente.
Aquí tiene siete consejos para optimizar su flujo de trabajo de análisis y generación de imágenes celulares 3D.
1. Utilice la instrumentación y la tecnología adecuadas para la generación de imágenes de cultivos celulares 3D
Cuando se trabaja con cultivos celulares 3D, no es suficiente adquirir una imagen de un plano celular, como en los cultivos celulares 2D tradicionales. En su lugar, debe tomar una serie de imágenes en planos verticales (normalmente10,15 imágenes), denominadas pilas en Z. Las plataformas de imágenes confocales automáticas, como el sistema de imágenes de alto contenido microconfocal ImageXpress®, le permiten adquirir imágenes de una sección óptica más fina de la estructura 3D y reducir significativamente la neblina de fondo, lo que resulta en una mejor resolución de imagen y un detalle celular más fino. Los objetivos de inmersión en agua del sistema ImageXpress también tienen un papel clave en la mejora de la calidad de la imagen.
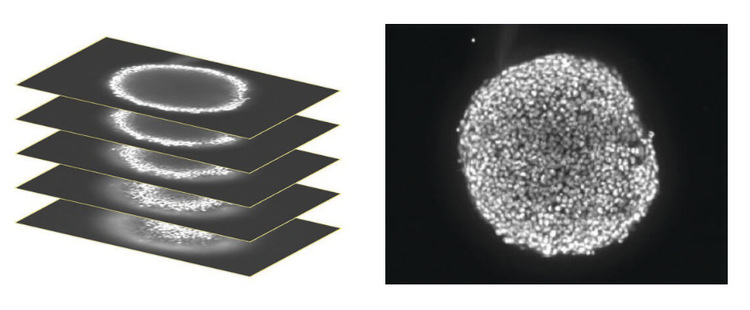
Se adquirió una pila de imágenes confocales en el plano Z que abarca aproximadamente la mitad de la profundidad del esferoide (izquierdo). Solo algunas células del esferoide están enfocadas en un plano determinado, por lo que para facilitar el análisis, las imágenes se contrajeron en una sola imagen 2D para combinar las áreas de enfoque (derecha).
2. Utilice microplacas diseñadas específicamente para imágenes 3D
Es importante utilizar microplacas diseñadas específicamente para imágenes 3D. Por lo general, estas son 96placas inferiores 384bien transparentes o . Las placas redondas con fondo en U de Corning son convenientes para la fabricación de esferoides y también son perfectas para la creación de imágenes en 3D. Estas placas le permiten mantener el esferoide centrado y en su lugar durante la adquisición de imágenes. Las placas de fondo plano por el contrario tienden a ser problemáticas, ya que dificultan el mantenimiento de la muestra centrada.
3. Siga las técnicas adecuadas de preparación de las células antes de la toma de imágenes
Es importante tener en cuenta el tipo de muestra 3D que está utilizando, ya que las diferentes muestras tienen diferentes requisitos de preparación y generación de imágenes. Al tratar con objetos sólidos, como esferoides o muestras de tejido grueso, hay una distancia limitada que puede ver debido a la limitada penetración de la luz y la dispersión de la luz que causa interferencia de las células. Como alternativa, las celdas de las matrices como Matrigel son transparentes, lo que le permite visualizar el objeto y realizar el análisis con una mayor penetración de la luz.
La tinción de objetos celulares 3D como esferoides puede ser dificultosa, ya que los tinciones tienen que penetrar no solo en la superficie, sino también en el interior de la muestra. En el caso de la tintura Hoechst, que se utiliza para la tinción nuclear, es posible que deba utilizar una concentración 2X-3X mayor para obtener una penetración eficaz. A su vez, es posible que deba permitir una mayor duración de la tinción. Normalmente, un colorante como Hoechst requiere 15-20 minutos para la tinción. Sin embargo, al tratar con esferoides, es posible que deba dejar pasar2 - 3horas para la tinción. Algunos tintes son lipofílicos y pueden quedarse atascados en la superficie en lugar de penetrar en la muestra. La manchado con anticuerpos es especialmente difícil y los científicos todavía están trabajando para desarrollar protocolos de manchado efectivos.
4. Localice la posición central de la muestra en 3D al inicio de la adquisición de imágenes
Para iniciar el proceso de imagen, primero debe encontrar la posición del objeto en el centro del sitio de la imagen y encontrar el primer enfoque que estaría aproximadamente en el centro de la posición z (posición vertical). Por ejemplo, si está visualizando un esferoide que tiene aproximadamente 500 micras de diámetro, la posición inicial sería aproximadamente 50 micras por encima de la parte inferior del hueco. En esta posición inicial, puede ajustar la exposición y los correctores de los diferentes canales.
A veces, los esferoides se desvían del centro, por lo que es posible que deba ajustar las dimensiones de la placa para asegurarse de que los esferoides estén centrados. También puede comprobar a través de la placa en diferentes esquinas para asegurarse de que los esferoides están a la vista.
5. Defina el rango de la adquisición de imágenes en 3D, de principio a fin
Esto implica adquirir una pila de imágenes a diferentes profundidades dentro del objeto y definir exactamente dónde debe comenzar, dónde debe terminar y también definir el número de pasos intermedios. Normalmente, para un objetivo 10X, puede comenzar con una distancia de 8-10 μm entre pasos. Para un objetivo 20X, comenzaría con una distancia de 3-5 μm entre pasos, y así sucesivamente.
Aunque aumentar el número de pasos mejora la calidad del análisis y la visualización, un número excesivo de imágenes puede prolongar el tiempo de adquisición y análisis y sobrecargar el almacenamiento de datos. Además, tomar demasiadas imágenes podría hacer que su muestra se desvanezca. Finalmente, es cuestión de experimentar para encontrar el equilibrio correcto. Normalmente utilizo dos protocolos diferentes para una sola placa. Uno utiliza una distancia mayor entre los cortes y el otro utiliza menos.
También es muy importante especificar el tipo de imagen de proyección que desea tomar al inicio de la adquisición. Normalmente, para la imagen confocal, el objeto se establece en “imagen de proyección máxima”, lo que genera automáticamente mucha información con respecto a la muestra. En este punto, puede elegir analizar solo la imagen de proyección en lugar del análisis 3D para acelerar el proceso.
6. Utilice los objetivos de inmersión de agua y QuickID para ayudar a reducir el tiempo de adquisición de imágenes
Durante la adquisición, los objetos 3D pueden alejarse del centro del pozo, lo que hace que sean difíciles de encontrar. Esto es especialmente cierto si está tratando con esferoides en placas de fondo plano. Para superar este problema, nuestro sistema microconfocal ImageXpress incluye una característica llamada adquisición de imágenes dirigidas QuickID . El sistema genera imágenes con bajo aumento para encontrar el objeto de interés y, a continuación, adquiere automáticamente el objeto de interés en un solo campo de visión con mayor aumento. Esto reduce significativamente el tiempo de adquisición y los requisitos de almacenamiento de datos. El uso de los objetivos de inmersión en agua también es beneficioso, ya que recogen una señal más alta de la muestra 3D, lo que le permite disminuir el tiempo de exposición y aumentar la velocidad de adquisición.
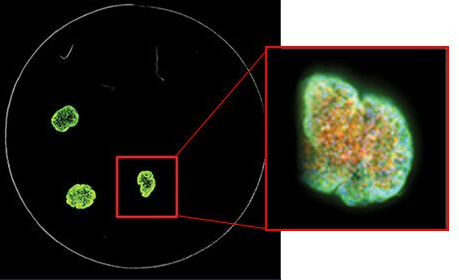

7. Utilice el software de análisis 3D adecuado
Nuestros sistemas de captura de imágenes celulares incluyen el software de adquisición y análisis de imágenes de alto contenido MetaXpress®, que proporciona muchas herramientas para hacer que el análisis sea un proceso más fluido. El enfoque más sencillo sería combinar las áreas de enfoque para su pila de imágenes en una sola proyección 2D utilizando el algoritmo de proyección máxima del software. Puede utilizar herramientas para el análisis 2D normal, como recuento de núcleos, puntuación de células y crecimiento de neuritas .
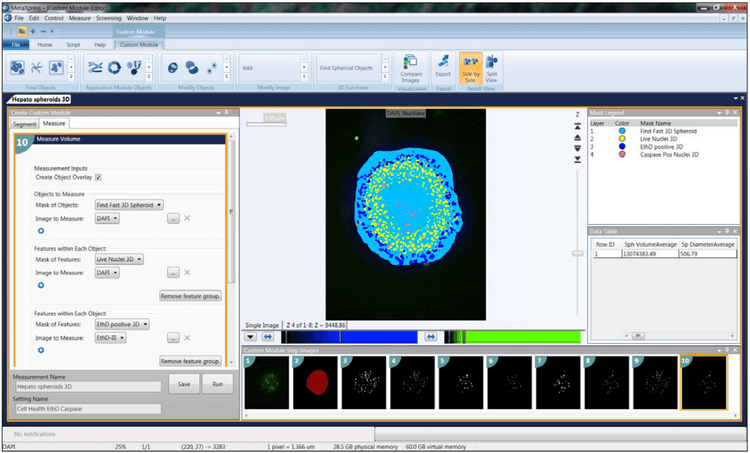
Para el análisis 3D, puede encontrar objetos de interés en cada pila en Z y luego combinarlos. Por ejemplo, si está trabajando con esferoides o células en Matrigel, la herramienta “Encontrar objeto redondo” le permite encontrar el objeto en un solo paso una vez que defina el tamaño aproximado del objeto y el umbral de intensidad. Otra herramienta común es “Conectar por mejor coincidencia”. Aquí, selecciona su protocolo de análisis (p. ej., recuento de núcleos, vivo/muerto o puntuación de células) y lo ejecuta por separado para cada corte z. A continuación, el algoritmo conecta ciertos objetos entre cortes z adyacentes en un volumen 3D basado en el desplazamiento máximo de objetos entre cortes que designe como aceptable. A continuación, puede visualizar los objetos en formato 3D y, lo que es más importante, puede realizar un análisis volumétrico 3D para identificar el volumen, la distancia entre objetos, etc.
Para Más información información sobre la optimización de su flujo de trabajo de análisis y generación de imágenes celulares 3D, consulte nuestra página web Modelos de celdas 3D.