
Los expertos en organoides analizan: Cómo navegar por las complejidades y ventajas de la obtención de imágenes 3D en la investigación con organoides
La biología humana es compleja, y la complicada maquinaria detrás de muchos procesos biológicos y enfermedades no se ha descubierto por completo. Dado que los modelos 2D no recapitulan esta complejidad, solo pueden ayudarnos a rayar la superficie. La falta de herramientas sólidas para predecir la eficacia y la seguridad de los fármacos es una de las razones por las que más del 90% de los candidatos actuales a fármacos fracasan en los ensayos clínicos (1). La obtención de imágenes 3D, al proporcionar modelos más relevantes y precisos, ofrece el potencial de mejorar esto; sin embargo, la obtención de imágenes 3D también trae consigo sus propios desafíos únicos que deben superarse para un éxito óptimo.
En un nuevo podcast con Drug Target Review, la Dra. Hilary Sherman (Científica Sénior de Aplicaciones en Corning Life Sciences) y la Dra. Oksana Sirenko (Directora Sénior de Desarrollo de Ensayos en Molecular Devices) analizan cómo las tecnologías de obtención de imágenes 3D pueden cubrir las brechas en la visualización y el análisis de modelos celulares complejos.
Hilary y Oksana tienen una experiencia considerable en el desarrollo y el uso de modelos celulares 3D. Analizan las ventajas que tienen los organoides en la emulación y predicción de la biología humana y sus respuestas, así como los desafíos que pueden surgir con la obtención de imágenes y el análisis de estas muestras.
¿Por qué 3D frente a 2D?
Los tejidos, órganos y tumores humanos no son estructuras 2D planas, sino conjuntos 3D bastante complejos compuestos por muchos tipos de células diferentes. Además, los procesos biológicos vitales, como la captación de nutrientes y fármacos, los gradientes de pH, la transducción de señales, la eliminación de residuos y las interacciones entre células, se producen en un contexto 3D. Estos fenómenos pueden afectar significativamente a la biología celular y a los mecanismos de acción de los fármacos, pero los modelos celulares 2D convencionales apenas capturan esta complejidad, si es que lo hacen. Por lo tanto, los fármacos y tratamientos que pueden funcionar bien en un contexto 2D no producen la misma eficacia cuando se utilizan in vivo. Esta desconexión entre los entornos 2D y 3D explica parcialmente por qué muchos fármacos que parecen prometedores en el laboratorio fracasan en los ensayos clínicos. Al construir sistemas 3D, podemos crear modelos celulares más relevantes biológicamente que imitan mejor los efectos de un fármaco o tratamiento en el “mundo real”.
Ventajas de los organoides frente a otros modelos celulares 3D
Los organoides también ofrecen ventajas frente a otros modelos celulares 3D de uso común.
Los organoides difieren de los esferoides porque son más estructurados y sofisticados. Mientras que los esferoides comprenden grupos de uno o dos tipos de células, los organoides se derivan de células progenitoras (es decir, madre) que se diferencian en múltiples tipos de células para crear un modelo de órgano real. La orientación de los diferentes tipos de células en los organoides representa mejor el órgano del cuerpo en términos de polaridad o luz, el centro del órgano similar a un vacío. Los científicos suelen encapsular organoides con matriz extracelular o colágeno para demostrar mejor las interacciones entre células y una orientación adecuada. Por lo tanto, los organoides son excelentes para simular la funcionalidad de un tejido u órgano determinado.
Cuando se trata de representar tejidos y órganos humanos complejos, los organoides y los órganos en un chip adoptan diferentes enfoques, aunque el objetivo final es similar. Organ-on-a-chip requiere un amplio conocimiento del órgano y su entorno que se está estudiando para un diseño funcional y controlado. Por el contrario, los organoides pueden diseñarse más fácilmente debido a la capacidad de las células madre para autoorganizarse intrínsecamente y diferenciarse en tipos de células funcionales.
Organoides de pulmón

Organoides colorrectales
¿Se pueden utilizar organoides en medicina personalizada?
Las características de los organoides descritas anteriormente los convierten en candidatos ideales para la medicina personalizada, especialmente para enfermedades con múltiples variantes en las que no hay un medicamento que funcione para todos los pacientes. Muchos subtipos de cáncer, como el cáncer de mama triple negativo, entran en esta categoría, y la respuesta quimioterapéutica varía considerablemente de una paciente a otra. Al derivar organoides de las biopsias de los pacientes, los científicos pueden crear organoides derivados del paciente (PDO), también conocidos como tumoroides. Esto les permite evaluar el efecto de varios compuestos sobre ese tipo de tumor específico, lo que en última instancia les permite predecir mejor la respuesta del individuo al tratamiento.
Complejidades de los organoides
Según Hilary, a pesar de los flujos de trabajo estandarizados para el desarrollo de organoides, se deben tener en cuenta muchos factores al trabajar con organoides. “Trabajar con esferoides es sencillo, ya que puede utilizar placas de forma similar a los cultivos celulares 2D en crecimiento. Cuando empieza a trabajar con organoides, el flujo de trabajo se vuelve mucho más complejo debido a las diversas formulaciones de medios y la necesidad de reactivos caros, como factores de crecimiento”.
Otro requisito es emplear la matriz Corning® Matrigel® como matriz extracelular (MEC), que es responsable de establecer la integridad o polaridad del organoide. Sin embargo, es un material difícil de utilizar debido a sus propiedades fisicoquímicas fluctuantes a diferentes temperaturas, lo que no solo plantea problemas para la manipulación de líquidos, sino que también requiere una optimización adicional al obtener imágenes de la estructura 3D.
Cada tipo de organoide alberga complejidades adicionales únicas debido a la variabilidad de los flujos de trabajo. Aunque muchos flujos de trabajo comienzan por diferenciar las células pluripotentes inducidas (iPCS) en células precursoras, los pasos posteriores pueden diferir dependiendo del tipo de célula precursora (p. ej., cardíaca, neuronal, hepática o intestinal). Por ejemplo, los organoides cerebrales (cerebro) requieren la transferencia de iPCS a un medio de inducción neuronal antes de transferirlos a las gotitas de la matriz de Matrigel. Otro ejemplo es el flujo de trabajo de organoides intestinales/rectales en el que los organoides rectales se cultivan en micropocillos microestampados con forma de U inferior Gri3D® en el hidrogel para aumentar la complejidad.

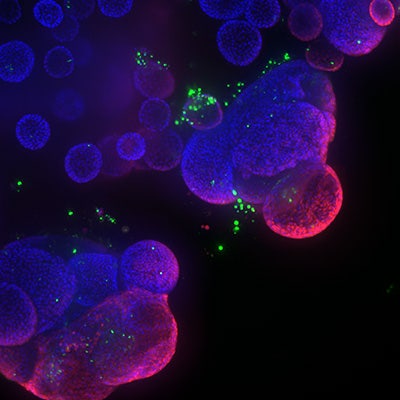
Imágenes confocales a gran aumento de organoides de recto humano expuestos a citoquinas proinflamatorias. Imágenes de plano único 40x de F-actina (magenta) y DAPI (azul). Imágenes de un solo plano 40X de F-actina (magenta) y DAPI (azul).
Desafíos en la obtención de imágenes y el análisis de imágenes
Además de las complejidades de la biología celular 3D, también pueden surgir desafíos al obtener imágenes de estos modelos. Puede ser más difícil para los reactivos de tinción penetrar en la estructura, y la falta de suficiente infiltración de luz y un enfoque adecuado puede afectar a la obtención de imágenes precisas
Al trabajar con organoides 3D complejos, los científicos deben tener en cuenta la penetración de los reactivos en el modelo celular. Es por eso que pueden ser necesarias consideraciones adicionales, como aumentar la concentración del tampón de permeabilización, prolongar el tiempo de incubación o aumentar la concentración de anticuerpos.
Oksana destaca la importancia de tiempos de tinción y fijación más largos, “Aunque media hora es suficiente para un cultivo 2D, necesitamos incubar organoides durante al menos dos horas con la tinción. La fijación también debe realizarse durante al menos dos horas, idealmente durante la noche”.
La modalidad de obtención de imágenes es otro factor crucial, y tanto la luz desenfocada como la penetración de la luz pueden presentar un desafío cuando se obtienen imágenes de organoides. Sin embargo, las funciones adicionales pueden mejorar la calidad de la imagen. Por ejemplo, la tecnología de inmersión en agua ayuda a aumentar tanto la resolución como la sensibilidad a diferentes niveles de aumento colocando una capa de agua entre el objetivo y la muestra, lo que finalmente produce imágenes más nítidas.
Los organoides son gruesos, por lo que la fuente de luz necesita tener suficiente potencia de iluminación para mejorar la resolución de la imagen y minimizar la aberración. Sin embargo, con la luz LED estándar, lograr el brillo deseado requiere largos tiempos de adquisición, lo que puede dar lugar a una menor intensidad de imagen y a un posible fotoblanqueo. Los lectores de imágenes confocales avanzados, como el sistema de adquisición de imágenes de alto contenido ImageXpress® Confocal HT.ai , utilizan una fuente láser multicanal de alta intensidad para aumentar la sensibilidad del ensayo y minimizar los tiempos de exposición.
Por último, un enfoque fiable es un aspecto crucial cuando se obtienen imágenes de organoides para capturar diferentes niveles de detalle sin sacrificar la resolución. Además, al combinar la adquisición de imágenes confocales de alto contenido con un software de análisis de imágenes robusto, los investigadores pueden generar perfiles fenotípicos completos que incluyen tamaño, área, volumen, densidad, distancia intercelular y estructuras subcelulares.
Otro desafío significativo durante la fase de análisis de imágenes es la complejidad y heterogeneidad de los objetos organoides y fenotipos, que presentan desafíos para el análisis. Los métodos de análisis permiten la caracterización de objetos mediante múltiples lecturas, incluidos volúmenes, áreas e intensidades, también permiten contar y caracterizar células e incluso estructuras subcelulares dentro de organoides. Herramientas de análisis avanzadas que incluyen elementos de aprendizaje automático para obtener información sobre fenotipos organoides y cambios en fenotipos como resultado de varios tratamientos.
Futuro del desarrollo de organoides y la obtención de imágenes
Con la velocidad a la que los protocolos organoides están desarrollando y las tecnologías de imagen están progresando, el siguiente paso importante en la investigación organoide es la integración de la automatización en los laboratorios para mejorar la velocidad del flujo de trabajo y aumentar la reproducibilidad. Según Oksana, las soluciones de automatización de flujos de trabajo de extremo a extremo están en su etapa inicial.
“Anteriormente nos centramos en la automatización de imágenes y análisis de imágenes, pero el siguiente paso es la capacidad de automatizar todo el flujo de trabajo. Esto implica automatizar cada parte de todo el recorrido celular: manipulador de líquidos, incubadora, centrifugadora, lector de placas, todo unido por un sistema robótico que puede navegar sin problemas entre cada componente. El brazo robótico puede mover las placas desde la incubadora hasta el manipulador de líquidos para la adición de medios, la siembra de células y la tinción. A continuación, puede transferir las placas al sistema de obtención de imágenes y al software de análisis para realizar análisis de alto contenido”.
Un ejemplo de dicho sistema automatizado es el Centro de Innovación de Organoides creado por Molecular Devices, una solución integral que estandariza el proceso de desarrollo de organoides con cultivo celular, tratamiento e incubación, hasta la obtención de imágenes, el análisis y el procesamiento de datos.
Además de la automatización, la optimización inicial es otro factor que determina el éxito del estudio de organoides. Hilary afirma: “Cuanto más tiempo se dedique a optimizar el proceso de investigación de organoides por adelantado al comprender la biología y la estructura del tipo de organoides específico, más sólida será la recopilación y el análisis de datos y mejor será la calidad que tendrán los datos relacionados con la imagen”.
Cuando se trata del descubrimiento de fármacos y el modelado de enfermedades, la investigación organoide está creciendo rápidamente y es muy prometedora. Al explorar opciones para su laboratorio, es importante invertir la investigación y los recursos adecuados para desarrollar un flujo de trabajo optimizado que produzca resultados reproducibles, fiables y precisos. Cuando se hace de forma óptima, los investigadores pueden beneficiarse de una mayor productividad, una mayor eficiencia, una mayor velocidad de comercialización y, lo que es más importante, una mejora de la calidad de vida de los pacientes.
Póngase en contacto hoy mismo con uno de nuestros expertos para saber cómo podemos ayudarle a optimizar su flujo de trabajo de biología 3D u organoides.
- Mullard, Asher. "Comparando las tasas de éxito clínico". Nature Reviews Drug Discovery 15,7 ( 2016): 447-448.