
Producción acelerada de anticuerpos monoclonales para el tratamiento del SARS-CoV-2
Con las soluciones de dispositivos moleculares, los científicos pueden acelerar el proceso de aprobación de la FDA y acelerar el descubrimiento de los anticuerpos monoclonales
La cronología para identificar y desarrollar anticuerpos de neutralización efectivos desde el punto de vista clínico contra las partículas virales desde el banco de trabajo hasta el paciente suele ser de 18 a 24 meses. La carrera mundial para identificar los anticuerpos de neutralización efectivos contra la proteína del pico del virus del SARS-CoV-2 se hizo una vida y la muerte importada a medida que el número de muertes globales aumentó en el primer año de la pandemia de la COVID-19.
Usando una combinación de instrumentos CloneSelect de dispositivos moleculares, con la impresora de celda única CloneSelect- y el generador de imágenes CloneSelect , la cronología para el desarrollo preclínico de anticuerpos de neutralización efectivos puede acortarse significativamente. De hecho, la velocidad a la que el mundo farmacéutico pudo crear e implementar los anticuerpos monoclonales contra el SARS-CoV-2 expresa el poder y la promesa de la automatización del desarrollo de líneas celulares.
En este artículo, demostramos los pasos para desarrollar anticuerpos monoclonales con instrumentos de dispositivos moleculares, desde la selección clonal hasta el seguimiento del crecimiento celular y la garantía de la monoclonalidad basada en imágenes. A continuación, se genera un informe de monoclonalidad basado en imágenes para incluirlo en aplicaciones de licencia global, como la Solicitud de licencia de productos biológicos (BLA) de la Administración de Drogas y Alimentación (Food and Drug Administration, FDA) de los EE. UU.
Anticuerpos monoclonales como alternativa a la terapia de plasma de convalecencia
Más recientemente, hay disponibles para su uso para tratar el virus del SARS-CoV-2 los anticuerpos monoclonales y los anticuerpos fabricados en laboratorio clonados a partir de glóbulos blancos. La palabra monoclonal describe una línea celular que se origina a partir de un solo progenitor (una célula) y se requiere documentar la evidencia de clonalidad para la presentación regulatoria. Los resultados preliminares demostraron que estos anticuerpos proporcionan soporte inmunológico durante al menos 5-7 meses [ 5]. Dado el potencial terapéutico, la producción rápida y eficiente de anticuerpos monoclonales se ha vuelto cada vez más crucial.
Hay un problema con los anticuerpos monoclonales: el tiempo desde el descubrimiento hasta los ensayos de prueba de concepto. La cronología desde la identificación del anticuerpo hasta el ensayo de fase I IND puede tardar hasta 10-12 meses [ 6]. Sin embargo, con la rápida y eficiente transfección, selección y detección de clones, hay formas de acelerar el proceso y reducir el plazo de producción a la mitad.
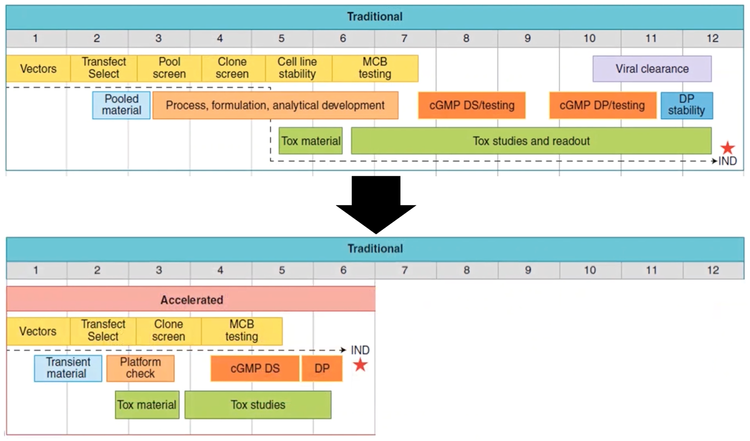
Figura 2 - El tiempo desde el descubrimiento hasta los ensayos de prueba de concepto podría reducirse a 5-6 meses desde una cronología tradicional de 10-12 meses.
Flujo de trabajo de desarrollo de anticuerpos monoclonales acelerada
A medida que las normativas para el desarrollo de líneas celulares se vuelven cada vez más estrictas, se requerirá a los investigadores que realicen la clonación de una sola célula y aporten evidencia de que una línea celular se deriva de una sola célula: prueba de clonalidad. Los métodos de clonación tradicionales (p. ej., limitación de la dilución y FACS) utilizan análisis estadísticos para determinar un nivel de confianza para la monoclonalidad. No obstante, la documentación de la monoclonalidad ha impulsado la necesidad de tecnologías y metodologías más sólidas en el bioprocesamiento. Muchos investigadores utilizan ahora de forma rutinaria sistemas de imagen, como el generador de imágenes CloneSelect, para verificar la monoclonalidad y monitorizar el crecimiento de las células en medios de cultivo celulares.
Un flujo de trabajo de producción ideal que genere una garantía de monoclonalidad aceptable consiste en los siguientes pasos.
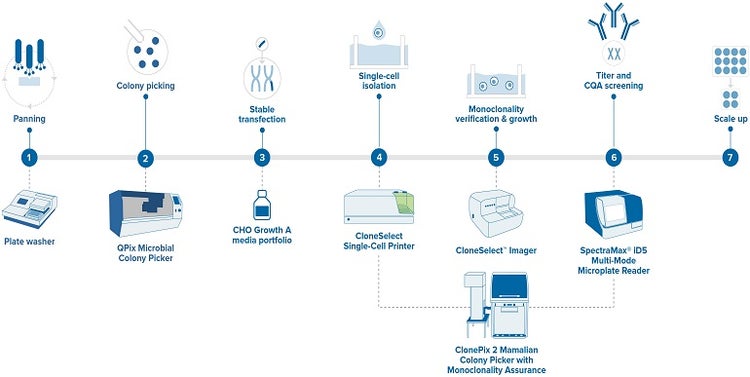
Figura 3 - Flujo de trabajo de desarrollo de anticuerpos monoclonales
Reto 1: Aislamiento de células individuales
La clave para una producción sólida de anticuerpos monoclonales es aislar las células individuales de alto rendimiento. Sin embargo, hay varios problemas de aislamiento de una sola célula, como la obtención de un número suficiente de células objetivo y el mantenimiento de la viabilidad de las mismas.
Dilución limitadora (DL) es un método de aislamiento tradicional, en el que el cultivo de la célula parental se somete a una serie de diluciones hasta que haya una célula por placa en un pozo basado en cálculos de probabilidad. El principal problema proviene de su baja eficiencia de aislamiento, lo que significa que el número de celdas por placa fluctúa entre cero y varias celdas [ 7].
La citometría de flujo (FC) es un método de aislamiento más exitoso que implementa la clasificación de las células activadas por fluorescente, pero pone en peligro la viaibilidad de las células, debido a la alta presión, la exposición a la carga eléctrica y las colisiones frecuentes de alta velocidad. Las condiciones inviables conducen a lo que se conoce como tensión celular inducida por clasificador (SICS) [ 8]. Por lo tanto, si está trabajando con tipos celulares sensibles, la línea celular obtenida a partir de la citometría de flujo puede no ser adecuada para una mayor investigación y establecer su cronología en meses.
La microfluídica, el proceso de aislar células individuales en virutas microfluídicas, ha ido emergiendo como una alternativa más eficiente a los métodos tradicionales. Un factor que hace que la microfluídica destaque es la enorme reducción en los volúmenes de entrada, ya que está cargando sus muestras en virutas de microlitros. Dado que los microchips tienen una menor presión de clasificación, también se reduce el riesgo de SICS. Por último, la microfluídica elimina el riesgo de contaminación de muestra a muestra [ 9].
Recientemente comparamos la eficiencia de célula única de estos tres métodos. Para la demostración del aislamiento basado en microfluídicas, utilizamos nuestra impresora de celda única CloneSelect que combina la tecnología con imágenes de alta resolución para aislar las células individuales mientras se registra la evidencia de la monoclonalidad basada en imágenes. Como puede ver en el gráfico de barras siguiente, la impresora de celda única CloneSelect superó a la distancia entre diámetro y eje por 8 veces y 10-20%, respectivamente.
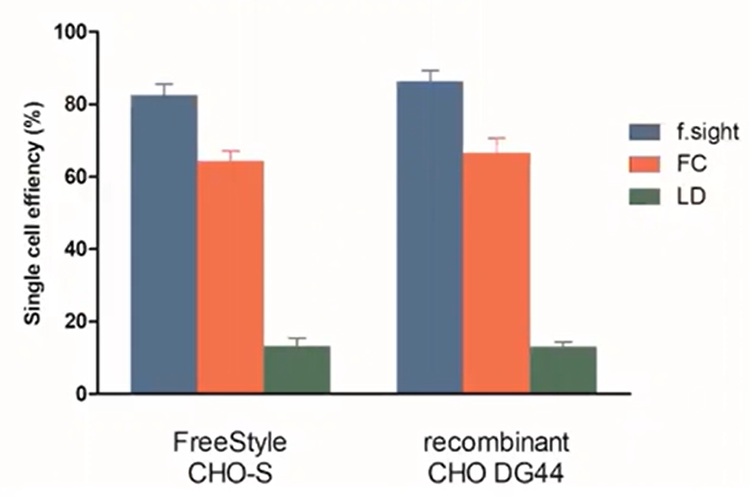
Figura 4 - Eficiencia de celda única: la vista F tiene una eficiencia de enchapado superior a la de la LD y la FC.
Reto 2: Eficiencia de la expulsión Colonial
La siguiente pregunta es: ¿Cómo se traduce la eficiencia unicelular cuando intenta generar colonias monoclonales?
Para la comparación del crecimiento de la salida de colonias de la microfluídica a la LD y la FC, utilizamos el generador de imágenes CloneSelect, que nos permite escanear la división desde una sola célula durante 90 segundos. El generador de imágenes CloneSelect proporcionó estadísticas de gráficos y miniaturas visuales del crecimiento celular como evidencia. Dado que el CSI permite el escaneado posterior de la placa durante 14 días, puede rastrearse fácilmente desde la imagen final hasta el día cero para probar que la colonia se formó a partir de una sola célula . Además, puede exportar las imágenes de su colonia como un informe en PDF o Word para garantizar la monoclonalidad basada en imágenes.
Entonces, ¿cómo contribuye esto a reducir la cronología? En lugar de un aislamiento de dos rondas para proporcionar una garantía basada en la probabilidad y en imágenes, podría utilizar una impresora de célula única y un generador de imágenes sinérgicamente durante una ronda de clonación. Se ha demostrado que este método proporciona una garantía de monoclonalidad con más de 99,99un % de confianza [ 10].
Los resultados de eficiencia de crecimiento se representan a continuación tanto para las células CHO de estilo libre como para las recombinantes.
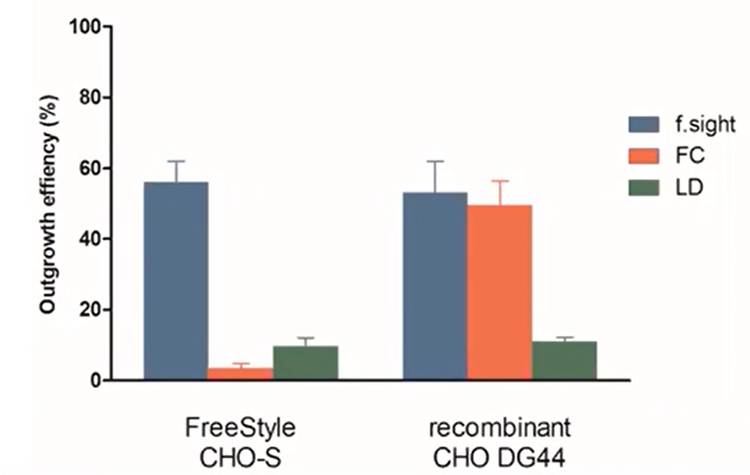
Figura 5 - Eficiencia del crecimiento de la columna: el f.sight muestra una mejora de más de cinco veces del crecimiento clonal frente a la dilución limitante tradicional.
De forma similar a la eficiencia unicelular, el rendimiento de la LD fue deficiente en ambas líneas celulares. Curiosamente, FC mostraba una eficiencia casi igual que CloneSelect Single-Cell Printer en las células recombinantes, pero 15 veces peor en las células de estilo libre. Esto indica claramente que la impresora de celda única CloneSelect, junto con la tecnología CloneSelect® Imager, es más consistente en términos de crecimiento de la columna que la CF.
Reto 3: Monoclonalidad y secreciones a gran escala
El aislamiento de los clones de células de mamífero candidatas puede ser extenuante y lento, ya que debe detectar la presencia de una gran cantidad de miles de clones, no solo en busca de la presencia de la presencia de una acumulación suficiente de anticuerpos.
Los dispositivos moleculares han desarrollado el sistema ClonePix® para un flujo de trabajo de desarrollo de líneas celulares automático de extremo a extremo con prueba de monoclonalidad. El sistema ClonePix está equipado para detectar y cuantificar los anticuerpos de neutralización liberados a partir de un gran número de clones CHO in situ . El software utiliza una sonda de detección fluorescente para cuantificar la secreciones y recoge automáticamente los clones con el mayor rendimiento.
Como se ilustra a continuación, el ClonePix® supera a la DC en varios aspectos. No solo puede inspeccionar un número constancialmente mayor de colonias utilizando menos placas, sino que también selecciona colonias que tienen un mayor rendimiento.
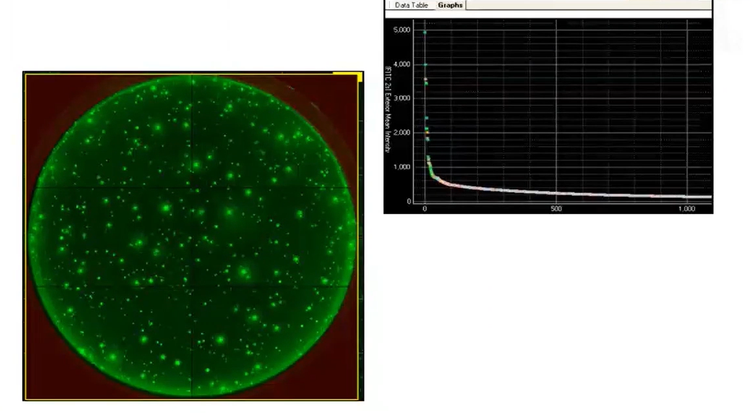
Figura 6 - ClonePix: in situ permite la fecha acumulativa en lugar de un solo punto temporal para determinar la productividad.
¿Y la reducción de la escala de tiempo? La versión original del flujo de trabajo del seleccionador de colonias de mamíferos ClonePix2 requiere dos rondas de selección, como sugiere la FDA, en conjunto con la combinación de impresora de celda única y generador de imágenes CloneSelect.
Explorar los flujos de trabajo de automatización del laboratorio
¡Hagamos que sus ideas se hagan realidad! Nuestros equipos de automatización y personalización han personalizado con éxito el recogedor de colonias de 2 mamíferos ClonePix para clientes a solicitud, incluyendo software y hardware. Por ejemplo, actualizando el sistema con capacidades de garantía monoclonal adicionales, un solo instrumento puede satisfacer todas las necesidades de flujo de trabajo de producción de anticuerpos monoclonales desde la selección de anticuerpos hasta el título con una ronda de selección de clones.
Con los flujos de trabajo de selección de clones automáticos de Molecular Devices, puede aliviar la carga en su laboratorio reduciendo significativamente el tiempo de intervención mientras crea un depósito central para los datos extraídos de varios procesos. Nuestras soluciones automatizadas unifican todos los dispositivos de su laboratorio para aumentar su rendimiento y eficiencia, reduciendo a la vez la interacción humana.
Referencias
- Mair-Jenkins, John, et al. "La eficacia del plasma de convaleciente y la inmunoglobulina hiperinmune para el tratamiento de las infecciones respiratorias agudas graves de la causa vírica: una revisión sistemática y un metaanálisis exploratorio”. El diario de las enfermedades infecciosas 211,1 ( 2015): 80-90.Mair-Jenkins, John, et al. “La eficacia del plasma de convaleciente y la inmunoglobulina hiperinmunitaria para el tratamiento de infecciones respiratorias agudas graves de etiología vírica: revisión sistemática y metanálisis exploratorio”. El Journal of infectious diseases 211,1 (2015): 80-90.
- Ko, Jae-Hoon, et al. "Retos de la terapia de infusión de plasma de convaleciente en la infección por el coronavirus de las vías respiratorias de Oriente Medio: una experiencia en un solo centro". Antivir ther 23,7 ( 2018): 617-622.Ko, Jae-Hoon, et al. “Retos de la terapia de infusión plasmática de convaleciente en la infección por coronavirus respiratorio de Oriente Medio: una experiencia en un único centro”. Antivir ther 23,7 (2018): 617-622.
- Shen, Chenguang, et al. "Tratamiento de pacientes en estado 5 crítico con COVID-19 con plasma de convaleciente". Jama 323,16 ( 2020): 1582-1589.Shen, Chenguang, et al. “Tratamiento de pacientes en estado 5 crítico con COVID-19 con plasma de convaleciente”. Jama 323,16 (2020): 1582-1589.
- Gontu, Abhinay, et al. "Ventana limitada para la donación de plasma de convaleciente con altos títulos de anticuerpos de neutralización de virus vivos para la inmunoterapia por la COVID-19". Biología de las comunicaciones 4,1 ( 2021): 1-9.Gontu, Abhinay, et al. “Ventana limitada para la donación de plasma de convaleciente con títulos elevados de anticuerpos neutralizantes de virus vivos para la inmunoterapia contra la COVID-19”. Biología de las comunicaciones 4,1 (2021): 1-9.
- Desgarrador, Tyler J., et al. "Los ensayos serológicos ortogonales de SARS-CoV-2 permiten la vigilancia de las comunidades de baja importancia y muestran una duradera inmunidad humoral". Inmunidad 53,5 ( 2020): 925-933.Ripperger, Tyler J., et al. “Los ensayos serológicos ortogonales de SARS-CoV-2 permiten la vigilancia de comunidades de baja prevalencia y revelan inmunidad humoral duradera”. Inmunidad 53,5 (2020): 925-933.
- Kelley, Brian. "Desarrollo de anticuerpos monoclonales terapéuticos a un ritmo de la pandemia". Biotecnología de la naturaleza 38,5 ( 2020): 540-545.Kelley, Brian. “Desarrollo de anticuerpos monoclonales terapéuticos al ritmo de la pandemia”. Biotecnología natural 38,5 (2020): 540-545.
- Heisler, E. y H. W. Vohr. "3D Modelos de piel humana/epidérmica y sistemas de explantación de piel humana y murina Organotípicos. La referencia enciclopédica de la inmunotoxicología." (2005).Heisler, E. y H. W. Vohr. "Modelos 3D de piel humana/epidérmicos y sistemas organotípicos de explantes de piel humana y murina. La referencia enciclopédica de la inmunotoxicología”. (2005).
- Hu, Ping, et al. "Aislamiento y análisis de una célula". Fronteras en biología celular y de desarrollo 4 ( 2016): 116.Hu, Ping, et al. "Aislamiento y análisis de células individuales". Fronteras en biología celular y del desarrollo 4 (2016): 116.
- bruto, Andre, et al. "Tecnologías para el aislamiento de una célula". Revista internacional de Ciencias moleculares 16,8 ( 2015): 16897-16919.Gross, Andre, et al. "Tecnologías para el aislamiento de células individuales". Revista internacional de ciencias moleculares 16,8 (2015): 16897-16919.
- Yim, Mandy y David Shaw. "Alcanzar una mayor eficiencia y mayor confianza en la clonación de una sola célula mediante la combinación de tecnología de impresión de celdas y de imágenes de placas". Progreso de la biotecnología 34,6 ( 2018): 1454-1459.Yim, Mandy y David Shaw. "Lograr una mayor eficiencia y confianza en la clonación de células individuales combinando tecnologías de impresión celular y de obtención de imágenes de placas". Progreso biotecnológico 34,6 (2018): 1454-1459.