
Consejos para realizar un experimento exitoso con adquisición de imágenes de células vivas
Durante la última década se han realizado avances importantes en microscopía y en tecnología de cámaras, así como en las tecnologías de marcaje de moléculas de interés. Estos avances han dado lugar a una mayor prevalencia de imágenes de células vivas en una amplia variedad de campos, desde la investigación básica hasta los estudios avanzados en neurobiología, biología del desarrollo, investigación sobre el cáncer y desarrollo de fármacos. En estos campos, se pueden utilizar imágenes de células vivas para estudiar los procesos celulares que se producen durante un período de tiempo desde el nivel de todo el organismo hasta el nivel molecular.
Aunque se pueden utilizar muchas aplicaciones para la captura de imágenes de células vivas y muchos métodos de microscopia diferentes, un problema común es mantener la integridad de la muestra durante el curso del experimento mientras se adquieren imágenes con suficiente resolución. Estos dos factores son cruciales para obtener datos relevantes y reproducibles de sus ensayos de imágenes de células vivas.
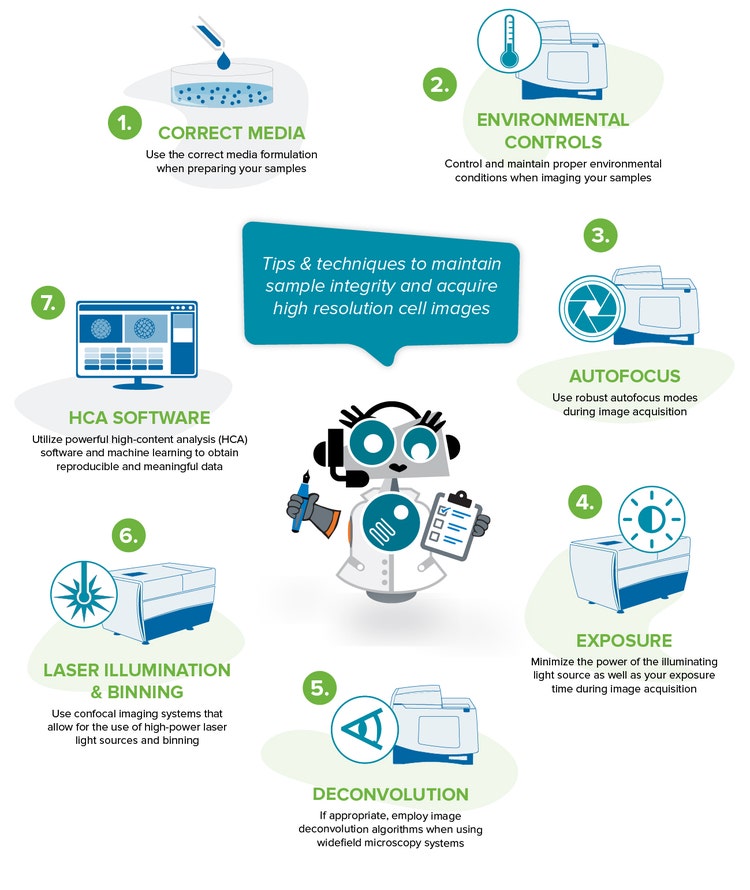
Mejores prácticas para obtener datos relevantes y reproducibles
Aquí hay algunos consejos y técnicas para ayudarle a mantener el estado de su muestra y ejecutar un exitoso experimento de imágenes de células vivas.
1. Utilice la fórmula de medios correcta al preparar sus muestras
Además de garantizar que las formulaciones de medios contienen los nutrientes adecuados para alimentar el crecimiento y el desarrollo de las células, tener en cuenta factores como el pH, la capacidad de almacenamiento y la osmolaridad es fundamental para ejecutar con éxito un experimento de imágenes de células vivas. Los cambios en el pH y la osmolaridad de los medios (es decir, la cantidad de soluto dentro de la solución de medios) pueden afectar a la expresión de las células, a su Fenotipo y, en última instancia, afectar a su aspecto y comportamiento. Regular y mantener condiciones ambientales óptimas ayudará a evitar cambios no deseados o nocivos en los medios.
Además, hay muchos factores dentro de los medios que pueden contribuir a la autofluorescencia de nuestra alta señal de fondo dentro de sus imágenes. Considere la posibilidad de utilizar medios sin rojo de feno, así como reducir la concentración de sérum. Esto reducirá en gran medida la señal de fondo.
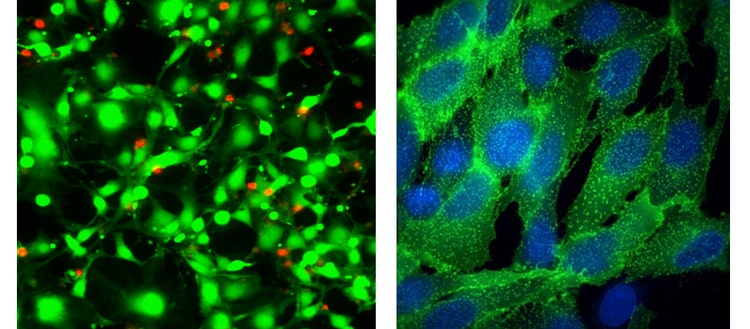
Izquierda: Imagen Apo de 40X Plan de las células HeLa tratadas con straurosporina durante 18 horas y luego teñidas con el ensayo EarlyTox-Hive Dead – calcein AM (verde) y etidio homodímero-III (rojo)
Derecha: Imágenes 100X Plan Apo (aire) de Transfluor U2OS tratadas con isoproterenol para estimular la internalización del receptor, que se visualiza mediante ß-arrestina marcada con GFP (verde). Las células se contratiñeron con la mancha 33342 nuclear de Hoechst.
2. Controle y mantenga condiciones ambientales adecuadas al obtener imágenes de sus muestras
Es importante mantener condiciones ambientales adecuadas para sus muestras a lo largo de todo el experimento de imágenes de células vivas. Los controles ambientales incluyen la temperatura, la humedad y el gas (es decir, oxígeno y dióxido de carbono).
La capacidad de regular y mantener una temperatura estable no solo mantiene la salud celular, sino que también reduce el riesgo de deriva de enfoque. La deriva del enfoque es la imposibilidad de mantener el enfoque con el tiempo. Normalmente se debe a variaciones de temperatura, que causan la expansión y contracción de los materiales utilizados para hacer la microplaca u otros recipientes de cultivo. Para reducir aún más el riesgo de encontrar deriva de enfoque debido a fluctuaciones térmicas, asegúrese de que la microplaca esté asentada en la platina del instrumento o en la cámara de control ambiental para permitir el equilibrio térmico antes de configurar los ajustes de adquisición. Además, si es necesario añadir medios a los pocillos durante el experimento de lapso de tiempo, asegúrese de que tenga la misma temperatura que el medio en el recipiente de imágenes. Las opciones de control de fluidos incorporadas, o la integración de automatización con manipuladores de líquidos para adiciones de medios y reactivos, aumenta el rendimiento y reduce al mínimo el riesgo de contaminar o alterar las células mediante la intervención manual.

Mantener una humedad adecuada ayuda a evitar la evaporación de los medios, especialmente en los ensayos de larga duración con células vivas. La vaporización causa cambios de osmolaridad que pueden afectar negativamente al comportamiento de las células y afectar al análisis. Si el control de la humedad no es una opción, se puede utilizar una solución hipotónica (de bajo soluto).
Controlar los niveles de dióxido de carbono también es importante, ya que ayuda a regular el pH dentro de su muestra. Si no puede controlar los niveles de dióxido de carbono, hay diferentes amortiguadores sintéticos, como HEPES, que se pueden utilizar para mantener el pH. Sin embargo, antes de su uso debe verificarse la compatibilidad entre las células de interés y el amortiguador sintético, ya que los amortiguadores sintéticos pueden ser nocivos para muchos tipos de células. Si las celdas son compatibles, HEPES debe utilizarse para estudios a corto plazo que duran unas horas, ya que el mantenimiento prolongado en medios amortiguados por HEPES podría ser nocivo para las celdas.
Mantener los niveles adecuados de oxígeno también es crítico, ya que los requisitos de oxígeno pueden variar ampliamente dependiendo del tipo de célula o de los requisitos del experimento de célula viva en particular.
Imágenes como el sistema de imágenes celulares automáticas ImageXpress® Pico y el sistema de imágenes de alto contenido ImageXpress® Confocal HT.ai incluyen una variedad de opciones de control ambiental para temperatura, humedad, oxígeno y dióxido de carbono. Dado que estos procesadores de imágenes se pueden integrar completamente con un sistema de control ambiental cerrado, las placas no están expuestas a la luz ambiente ni a otras condiciones externas del laboratorio que podrían comprometer la integridad de la muestra. Además, el software de los sistemas ImageXpress le permite supervisar con precisión el entorno móvil durante el curso del experimento a través de lecturas de sensores de control ambiental.
3. Utilice modos de autofoco robustos durante la adquisición de imágenes
Nuestros sistemas ImageXpress están diseñados con una amplia variedad de modos de autofoco de hardware (láser y LED) y software (basados en imágenes) que le permiten encontrar y conservar imágenes de enfoque entre experimentos y minimizar la deriva de enfoque. Los modos de autofoco pueden adaptarse a una amplia gama de muestras, grosores de vasos de cultivo, objetivos y parámetros de imagen.
Los métodos de autoenfoque de hardware funcionan para la mayoría de las muestras y son independientes de la calidad y el brillo de la muestra. El autofoco de hardware permite velocidades de adquisición más rápidas, lo que reduce al mínimo el fotoblanqueo de las muestras. Cuando la posición Z de la muestra varía con el tiempo o a través de una placa, la adición de métodos de autofoco por software puede ayudar a proporcionar un enfoque fiable en toda la muestra y el material de laboratorio. En la mayoría de los casos, cuando se requiere un enfoque basado en software, tanto el hardware como el autofoco del software deben estar habilitados. El autoenfoque del hardware encontrará la placa inferior, la parte inferior del hueco o ambas superficies. A continuación, el autoenfoque del software utilizará el contraste de imagen para encontrar el plano focal ideal. Por lo tanto, las muestras deben estar brillantes y libres de residuos para que el autofoco del software funcione de forma óptima.
A diferencia del autofoco de hardware, el autofoco de software disminuye las velocidades de adquisición y corre el riesgo de muestras de fotoblanqueo. Para aliviar esto, el autofoco del software debe estar habilitado para el primer canal que se adquiere, y la luz transmitida se puede utilizar como este primer canal en lugar de un canal fluorescente. Además, reduzca el tiempo de exposición y utilice fluoróforos más brillantes y estables. Herramientas como el binning (consulte # 6) también se pueden utilizar para ayudar a reducir los tiempos de exposición.
Los métodos de autoenfoque del software deben utilizarse solos cuando el autoenfoque del hardware no se haya configurado para su placa, el autoenfoque del hardware falle debido a imperfecciones de la placa, un bajo volumen en los cavidades disminuya la fiabilidad del autoenfoque del hardware o cuando se estén utilizando objetivos de inmersión de aceite.
El software de adquisición y análisis de imágenes de alto contenido MetaXpress® permite a los usuarios configurar los ajustes de autoenfoque para satisfacer las necesidades de un análisis en particular. Cuando se realizan rápidamente ensayos de time-lapse cinéticos en un solo pozo, el autofoco se puede aplicar al primer punto temporal solo para aumentar la velocidad de adquisición. Para los experimentos de lapso de tiempo a largo plazo o cuando la velocidad de imagen no es crítica, el autofoco se puede establecer en todos los puntos temporales para reducir la deriva de enfoque.
En el software de adquisición y análisis de imágenes CellReporterXpress® se pueden habilitar diversas rutinas de autofoco de hardware y software. Cada uno está diseñado para casos de uso específicos, lo que proporciona opciones de enfoque sin igual para una amplia variedad de muestras. Por ejemplo, la rutina de autoenfoque del hardware de inserto de cavidades detecta tres picos (placa inferior, cavidad inferior e inserto de cavidades) para una detección rápida y un enfoque óptimo del material de laboratorio que contiene tres superficies diferentes. Para las adquisiciones que requieren una velocidad aumentada a bajo aumento, la rutina Posición de enfoque del anclaje retiene la posición Z de in-focus seleccionada, desactiva el autofoco y adquiere imágenes con esta posición de enfoque guardada. Esto resulta especialmente útil al trabajar con muestras macroscópicas como organismos o tejidos enteros.
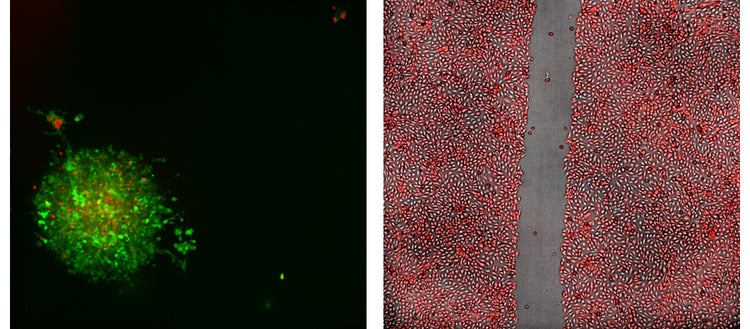
Izquierda: Imagen de proyección 2D confocal representativa de 20X de un análisis de inmunooncología que muestra un esferoide de cáncer de colon de ratón; hecho de células MC38 que expresan GFP, tratadas con células T que expresan RFP.
Derecha: Imagen 4X de la prueba de curación de la herida de las células Sigma U2OS que se transfectaron de forma estable para expresión de RFP.
4. Minimice la potencia de la fuente de luz de iluminación, así como el tiempo de exposición durante la adquisición de imágenes
La potencia de la fuente de luz lumínica y el tiempo de exposición pueden causar fototoxicidad de las células. Incluso pequeños cambios en las células pueden afectar a su comportamiento o expresión genética. Por lo tanto, debe encontrar el equilibrio correcto, donde pueda adquirir una imagen de calidad sin exponer su muestra a demasiada luz.
En términos de iluminación, cuando un fluoróforo o una molécula fluorescente se pone en un estado de salida, genera radicales libres que pueden causar daño al ADN y tensión sobre las células. Cuanto mayor sea la intensidad de la luz, mayor será el estado de excitación, lo que puede provocar fototoxicidad o daños en las células. Se sabe que la luz ultravioleta (UV) es más fototóxica, por lo que el uso de fluoróforos excitables como DAPI puede producir más fototoxicidad, en comparación con el uso de fluoróforos verdes o rojos.
En lo que se refiere a imágenes de fluorescencia o imágenes multicolor, es mejor utilizar fluoróforos de alta señal a ruido muy brillantes y fotosestables con picos de emisión distintivos. Esto le permite reducir el tiempo de exposición. El sistema ImageXpress incluye cubos de filtro de paso de banda estrecha para ayudar a eliminar la diafonía. También incluye fuentes de luz de alta potencia que se pueden atenuar y controlar. El sistema ImageXpress Confocal HT.ai, por ejemplo, incluye una fuente de luz láser de siete canales con ocho canales de imagen para adaptarse a los experimentos de etiquetado multicolor, como las aplicaciones de pintura de celdas.
Los objetivos de alta apertura numérica (NA), como los objetivos de inmersión en agua, le permiten generar imágenes de alta resolución más brillantes en tiempos de exposición más bajos. Cuando se utilizan altos objetivos de NA, es preferible utilizar microplacas de plástico delgado o placas de cultivo (es decir, aquellas que tienen el grosor de un cubreobjetos). También es preferible el uso de microplacas de pared negra y fondo transparente, ya que generan menos autofluorescencia.
5. Si corresponde, utilice algoritmos de deconvolución de imágenes cuando utilice sistemas de microscopia de campo amplio
Los sistemas de microscopia de campo amplio, como el sistema ImageXpress Pico y el sistema de imágenes de alto contenido microconfocal ImageXpress®, son óptimos para ejecutar ensayos de imágenes de células vivas. Para aumentar la resolución o la sensibilidad con estos sistemas, se pueden utilizar algoritmos de desconvolución de imágenes. El funcionamiento del software de deconvolución de imágenes reduce la luz desenfocada durante la adquisición, lo que le permite reducir los tiempos de exposición y mantener la calidad del análisis. Sin embargo, la deconvolución debe aplicarse con precisión y cuidado para no generar artefactos.
6. Utilice sistemas de imágenes confocales que permitan el uso de fuentes de luz láser de alta potencia y el binning
Los sistemas de microscopia confocal, como el sistema confocal ImageXpress HT.ai incluyen fuentes de luz láser que se utilizan mejor para obtener imágenes de muestras 3D, muestras gruesas o fluoróforos tenues (p. ej., proteínas etiquetadas con fluorescentes). Los instrumentos confocales le permiten regular y controlar la potencia de intensidad de la luz láser y LED.
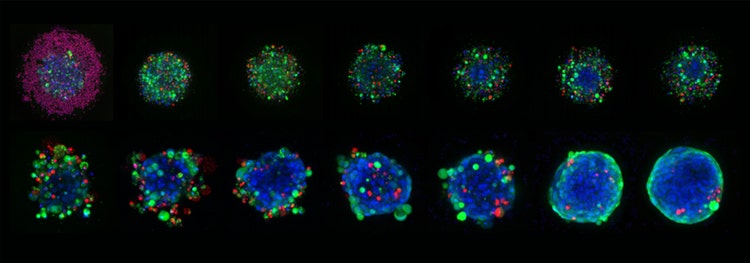
Imágenes Apo del plan 10X representativas de esferoides HCT116 cultivados en placas de microcavidad de Elplasia de Corning y tratados con concentraciones variables de estaurosporina durante seis días en total. Los esferoides se tiñeron con Hoechst 33342 (azul, núcleos), calcein AM (verde, células vivas) y etidio homodímero-III (glóbulos rojos, muertos).
La unión es otra herramienta que se puede utilizar al adquirir imágenes en campo amplio o confocal, aunque los efectos de la unión son más evidentes al adquirir imágenes con instrumentos confocales. Dado que la configuración del disco giratorio del sistema confocal limita la cantidad de luz que golpea la muestra y bloquea la luz desenfocada, normalmente debe utilizar tiempos de exposición más altos o luz de mayor intensidad. La unión alivia la necesidad de hacerlo mediante la combinación de la señal de carga eléctrica o intensidad de los píxeles adyacentes y la generación de una suma de intensidades de píxeles en una región determinada. Esta suma le da una intensidad más alta. Básicamente, el binning aumenta la señal al ruido en la imagen, lo que le permite utilizar un menor tiempo de exposición y una menor intensidad lumínica. Sin embargo, esto disminuye la resolución espacial. Una vez más, es cuestión de encontrar el equilibrio entre adquirir una imagen de calidad y mantener la salud de su muestra.
7. Utilice un software de análisis potente para obtener datos reproducibles y significativos
Las aplicaciones de imágenes de células vivas requieren la capacidad de extraer cantidades relevantes y enormes de datos cuantitativos de conjuntos de datos e imágenes grandes y a veces complejos.
Las soluciones de análisis de alto contenido (HCA) como nuestro software MetaXpress y CellReporterXpress® incluyen algoritmos de análisis robustos para segmentar con precisión las imágenes y generar datos reproducibles. Incluyen módulos de análisis preconfigurados para una variedad de aplicaciones de imágenes de células vivas. Se puede realizar un análisis más personalizado utilizando el Editor de módulos de cliente dentro del software MetaXpress.
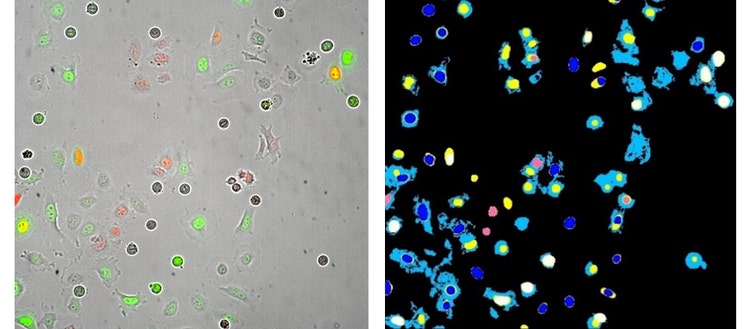
Izquierda: Imagen Apo de 20X Plan de las células HeLa transfectadas con los sensores de ciclo de célula Fucci (GFP - geminina y RFP-Cdt-1). Esta imagen se tomó 13 horas después del tratamiento con el inhibidor del ciclo celular noccodazole.
Derecha : Máscaras de segmentación de análisis generadas a partir de un análisis de módulo personalizado MetaXpress.
Si está buscando obtener información más detallada sobre las celdas que se están estudiando, se pueden utilizar algoritmos de aprendizaje automático con capacidades de análisis de datos avanzados. El paquete de software de análisis de imágenes IN Carta- de Microsoft contiene flujos de trabajo de aprendizaje automático guiados para mejorar la precisión del análisis y clasificar y comparar grandes cantidades de datos de imágenes heterógenas.
Dado que los experimentos de imágenes de células vivas generan muchos datos, es fundamental tener una capacidad de almacenamiento adecuada y poder de procesamiento para el análisis de datos. Como se ha mencionado anteriormente, el binning puede reducir el tamaño de los datos de imagen y permitir una velocidad de transferencia de datos más rápida para que las imágenes se puedan analizar más rápido. El sistema ImageXpress también incluye el software de análisis de imágenes distribuidas de alto contenido MetaXpress® Powercore, que utiliza el procesamiento paralelo para aumentar dramáticamente la velocidad de análisis.
Para Más información información sobre las diversas aplicaciones y técnicas utilizadas para la captura de imágenes de células vivas, visite nuestra página Imagen de células vivas.