Función de los anticuerpos monoclonales frente a la COVID-19
Descubra por qué los AcM son fundamentales para luchar contra el SARS-CoV-2 y cómo la pandemia ha conformado su proceso de descubrimiento y desarrollo.
Durante los últimos tres años, el desarrollo de tratamientos para la COVID-19 ha ganado un impulso considerable. La vacunación ha estado a la cabeza de la batalla. A través de la administración de ARNm, las vacunas impulsan a las células a producir una versión inofensiva de la proteína del pico, lo que estimula el sistema inmunitario para que produzca anticuerpos para combatir la posible amenaza. La pregunta es qué sucede cuando ya ha contraído la COVID-19 o su sistema inmunitario se ve comprometido de tal manera que corre un alto riesgo de ser internado incluso después de la vacunación. Ahí es donde intervienen los anticuerpos monoclonales al actuar sobre el virus y neutralizarlo después de que este invada el cuerpo.
Pódcast destacado
En el podcast más reciente con Drug Target Review (Episodio 6 - mAbs y SARS-CoV-2 con el Dr. Carter Mitchell y el Dr. Sharath Madasu, Kemp Proteins ), Carter Mitchell, director científico y Sharath Madasu, director de caracterización de proteínas de Kemp Proteins , discutieron el papel de los anticuerpos monoclonales (mAb) contra la COVID-19 y cómo la pandemia ha dado forma a su descubrimiento y desarrollo.
Revisión del objetivo de la droga · Episodio 6 - Acm y SARS-CoV-2 con el Dr. Carter Mitchell y el Dr. Sharath Madasu, Kemp Proteins
Tabla de contenidos
¿Por qué los mAb son efectivos contra el SARS-CoV-2?
Los anticuerpos monoclonales (AcM) actúan sobre los virus a través de la neutralización viral. Son efectivos porque interrumpen el proceso mediante el cual el virus reconoce al huésped o el virus está internalizado.
Mecanismo de trabajo de los anticuerpos monoclonales
En el SARS-CoV-2, el objetivo es interrumpir la unión de la proteína del pico con los receptorES-ES ACE2, prohibiendo la entrada del virus en las células huésped. La proteína del pico media la unión a través de su dominio de unión de reconocimiento (RBD). Actualmente, la mayoría de los anticuerpos monoclonales de neutralización se elevan contra el RBD.
¿En qué medida son efectivos los anticuerpos monoclonales contra las variantes de la COVID-19?
Cuando se trata de eficacia, es difícil dar una única respuesta debido al número cada vez mayor de variantes. La eficacia varía entre las variantes. Por ejemplo, aunque la mayoría de los anticuerpos autorizados para uso de emergencia funcionan en las variantes alfa y triángulo, muestran una menor eficacia en la variable ómicrónica.
El problema con Ómicron es que hay al menos 36 mutaciones en la proteína del pico, algunas de las cuales se encuentran en el RBD. Estas mutaciones dan lugar a una glicosilación diferencial, lo que permite al virus evadir las respuestas inmunológicas previamente formadas o la neutralización de los anticuerpos monoclonales.
Afortunadamente, los anticuerpos más nuevos, como Sotrovimab, consiguieron retener su actividad de neutralización en las variantes recientes, por lo que todavía hay un deslumbramiento de esperanza. Sin embargo, la eficacia puede variar en gran medida. Algunos anticuerpos son muy efectivos contra las variantes alfa y beta, pero no contra las variantes Gamma o Delta. Por el contrario, los anticuerpos efectivos contra Delta y Alpha son mucho menos efectivos contra las variantes Beta, Gamma y Ómicron.
El impacto de una variable de mutación en particular en EC50 depende de si las mutaciones están en el epítopo de unión o no.
Las ventajas de los mAb frente a otros tratamientos contra la Covid-19
El nivel de certidumbre en la dosificación requerida es una de las principales ventajas de los anticuerpos monoclonales en el tratamiento de la COVID-19.
Según el Dr. Madasu, la tasa de éxito de la terapia de plasma de convalecencia depende en gran medida del donador. Madasu explica más: “Con la terapia de plasma de convalecencia, A) espera que el donador siga produciendo anticuerpos de neutralización, y B) el donador está produciendo cantidades suficientes para ser eficaz en absoluto. Con los anticuerpos monoclonales sabemos exactamente cuánto se está administrando al paciente como anticuerpo de neutralización, lo que supone una enorme ventaja”.
La terapia con plasma de convaleciente también provoca un riesgo considerable de incompatibles en el plasma entre los pacientes. El uso de anticuerpos monoclonales como método de tratamiento eficaz contra la COVID-19 reduce estos riesgos de forma significativa.
El Dr. Mitchell enfatiza otra característica notable de la terapia con mAb, la capacidad de producir un subconjunto de mezcla seudo policlonal que puede neutralizar cualquier tipo de variación que pueda aparecer en el futuro. Uno podría preguntar: ¿Cómo podemos estar tan seguros de que estos anticuerpos serán efectivos contra futuras variantes? Dado que cada subconjunto tiene un epítopo de unión específico, las mutaciones pueden ser reconocidas rápidamente por uno o una combinación de subconjuntos de mAb.
El Dr. Mitchell ofrece un ejemplo plausible de los posibles beneficios de las mezclas policlonales. “Cinco años después, si surge un nuevo tipo de variable, podríamos utilizar un anticuerpo monoclonal elevado contra el tipo salvaje MÁS uno que salió 2023 como un tratamiento combinado para tener más eficacia contra esa variable en particular”.
El efecto de una pandemia repentina
Innegablemente, el crecimiento de los anticuerpos monoclonales ha estado avanzando. La pregunta sigue siendo: ¿Seguían produciéndose avances en la producción de anticuerpos monoclonales si no hubiera sido por la pandemia de la COVID-19?
Aunque ya se había establecido el proceso para el desarrollo de anticuerpos monoclonales, la pandemia creó un sentido de urgencia. El Dr. Madasu también cree que las personas tienen una comprensión más fácil/mejor de las terapias con anticuerpos que la de las vacunas. Durante la fase inicial de la pandemia, no estaba claro la eficacia de una vacuna, por lo que ciertas secciones de personas pueden haber dudado en tomar la vacuna. Por otro lado, las personas tenían un mayor sentido de comprensión de los anticuerpos, por lo que los tratamientos basados en anticuerpos fueron más ampliamente aceptados.
La pandemia no solo aceleró la mejora de las estrategias existentes, sino que también motivó el desarrollo de nuevas técnicas. Las tecnologías, como la resonancia de plasmón de superficie (SPR) de alto rendimiento o la interferometría de biocapa (BLI) de alto rendimiento, han despertado interés durante la pandemia. Además, la distribución dinámica de luz (DLS) y la FLD de alto rendimiento también han mejorado mucho. Una de las nuevas tecnologías fue el diseño de anticuerpos monoclonales De Novo basado en la inteligencia artificial, que aumentó la velocidad y la complejidad de las plataformas de detección de anticuerpos .
Flujo de trabajo de anticuerpos monoclonales contra la COVID-19
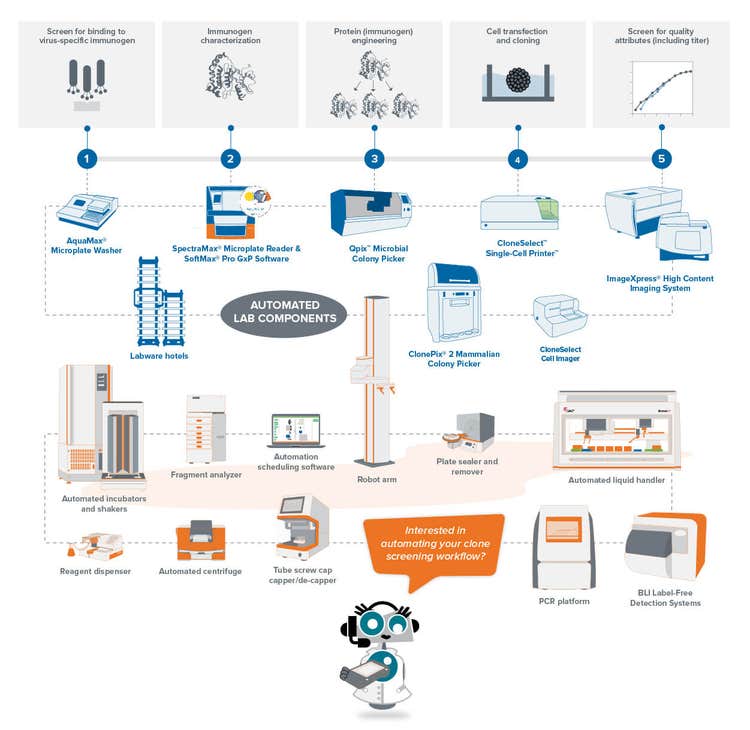
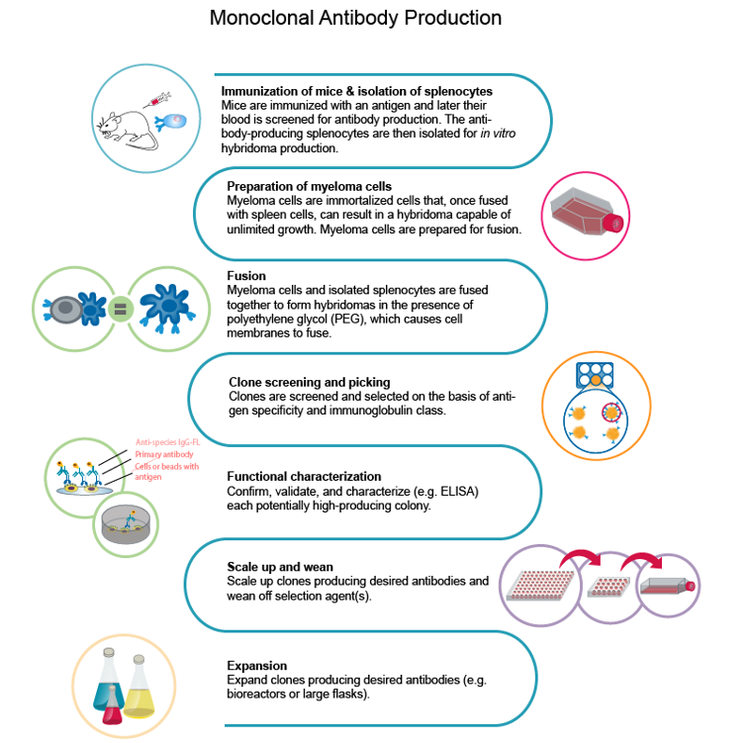
El primer paso para construir el flujo de trabajo es elegir el antígeno que se utilizará para el desarrollo de anticuerpos monoclonales . En la etapa inicial, la inmunización se produce mediante la administración del antígeno en un animal que desarrolle una respuesta inmune. A continuación, se aíslan las células beta generadas durante la respuesta inmune en los animales, seguidas de la fusión con una célula de mieloma para generar el hibridoma.
Según el Dr. Mitchell, la clave para una etapa inicial exitosa es la optimización del antígeno. “En el caso de la COVID-19, los anticuerpos se elevan principalmente contra la proteína del pico, que es un trímero. La proteína del pico tiene una propensión a formar agregados de alto peso molecular, lo que puede no ser bueno para la estrategia de inmunización”.
Para añadirlo, los patrones de glicosilación de la proteína del pico varían mucho entre los tipos de célula, por no hablar de las diferentes especies.
Por eso, hay que tener mucho cuidado con la selección del antígeno. Incluso una ligera desviación de un único glicano de antígeno (p. ej., en diferentes variantes) puede afectar significativamente a la tasa de éxito del anticuerpo.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonal-antibody-production
Retos y cuellos de botella
Inmunización
Uno de los principales problemas es la comprensión del genoma vírico. Los equipos de investigación generalmente tenían que sintetizar y purificar los antígenos y optimizar su expresión. Sin embargo, para evaluar el éxito de la expresión y la purificación, tenían que depender de la naturaleza colaborativa de los científicos para publicar la información de sus propios laboratorio. En general, la inmunización de un animal y la generación de hibridoma por sí sola podrían tardar hasta ocho semanas.
Aislamiento de célula única
Tras identificar el antígeno de mejor calidad para la estrategia de inmunización, el siguiente desafío es obtener un número suficiente de linfocitos B para el aislamiento de células individuales del hibridoma.
El método tradicional para desarrollar estos hibridomas es un medio semisólido que permite que la célula única forme una colonia. Este solía ser un proceso lento, pero desde entonces ha ganado impulso con instrumentos robóticos que permiten imprimir celdas individuales en cada uno de los cavidades de una placa de micropocillos, lo que mejora tanto el rendimiento como la eficiencia.
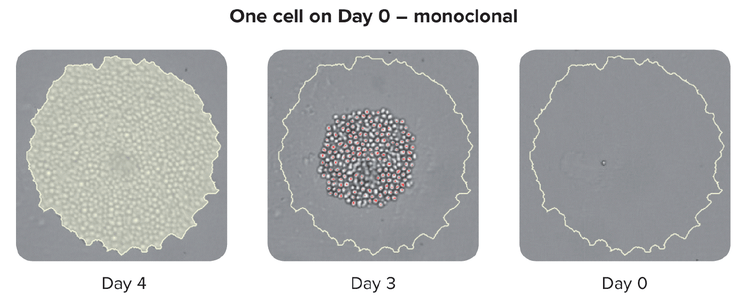
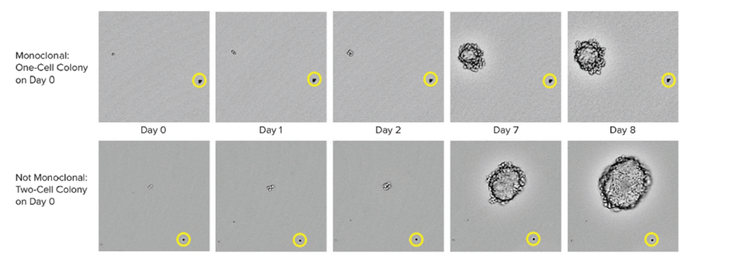
Es importante tener en cuenta que las herramientas de aislamiento avanzado de célula única también proporcionan una mayor eficiencia de crecimiento clonal y verificación de la monoclonalidad de que la colonia se generó a partir de una célula única.
Anticuerpo a gran escala
Para la monoclonalidad a gran escala, se necesita generar la forma recombinante de un hibridoma aislado de una célula porque el aislamiento de una célula es insuficiente para la generación de mAb relevantes desde el punto de vista clínico. La aprobación de los ensayos clínicos requeriría la generación recombinante del mAb y su fórmula en un anticuerpo humano que permita una respuesta inmunológica adecuada.
Para formar líneas celulares estables para generar AcM a concentraciones suficientes, es necesario secuenciar y manipular el gen en un constructo humano. Las líneas celulares de CHO se utilizan para la generación recombinante, con el objetivo de 8-20 g/L de producción de mAb.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonality
Restricciones de tiempo y financieras
El tiempo y el coste son factores clave a tener en cuenta en los flujos de trabajo de mAb
Aunque la generación de clones estables se puede lograr en 12 días tras la alimentación inicial, la garantía completa del monoclonal podría tardar hasta seis meses con los métodos de clonación tradicionales. Y lo que es más importante, generar una estructura de mAb totalmente realizada puede ser costoso. La solución sería formar anticuerpos contra fragmentos de variables de cadena única o nanocuerpos de VHH. Estos son los fragmentos de anticuerpo más pequeños posibles que muestran una unión específica por la unión de un antígeno. El Dr. Mitchell resume por qué este enfoque es tan poderosa:
“Al convertir mAb en cuerpos nano más pequeños, podemos producirlos en E. coli de una manera mucho más económica. Eso reduce los costes, lo que lo convierte en un producto terapéutico ampliamente aplicable en lugar de uno solo accesible en los países desarrollados”.
Según el Dr. Madasu, sus estructuras estables hacen que la distribución en los países menos desarrollados sea más fácil. “Tenemos que pensar en otros países menos desarrollados sin acceso a las instalaciones de almacenamiento. Algunos de estos cuerpos son bastante estables y podrían almacenarse en condiciones menos estrictas”.
Está claro que la conversión de anticuerpos a cuerpos autónomos es un paso crucial para distribuir las terapias a base de mAbs por todo el mundo a un menor coste. Especialmente en los países menos desarrollados con instalaciones de almacenamiento insuficientes, los cuerpos metálicos seguirían siendo estables en temperaturas extremas.
Garantizando la monoclonalidad y acelerando la producción de mAb de la COVID-19 con automatización
Garantía de monoclonalidad
Entre los métodos para garantizar la monoclonalidad a escala se incluyen las tecnologías automáticas, como la impresión de una célula o la selección de colonias. Al seleccionar una colonia aislada del medio HAT, el instrumento toma imágenes a lo largo de un lapso de tiempo desde el día cero después de seleccionar la colonia. La prueba de presencia ocular constituye una prueba de monoclonalidad. Para garantizar el alto rendimiento de los clones, los laboratorio pueden utilizar ensayos basados en células o basados en sistemas inmunes combinados con métodos basados en imágenes. Esta estrategia combinada garantiza que usted tenga la monoclonalidad y que sus clones estén excretando una única variedad del anticuerpo. Como paso final del proceso, también es útil ejecutar ensayos de unión de epítopos para determinar si la unión de epítopos es uniforme.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonality
El papel de la robótica en el tiempo de respuesta
La forma definitiva de reducir el tiempo de programación del desarrollo es implementar la robótica de alto rendimiento para interrogar a los clones. En los flujos de trabajo de mAb automáticos para la COVID-19, la purificación automática ha sido de inmensa ayuda para comprender el comportamiento de los clones y la posibilidad de que el anticuerpo monoclonal produzca agregados de alto peso molecular.
Utilizar la robótica de forma de alto rendimiento siempre es una ventaja para llevar nuevos productos terapéuticos al mercado. Este método proporciona una mejor visión general del espacio de las proteínas o del espacio de los epítopos. Tener un alto número de clones aumenta al máximo las posibilidades de obtener mAb que cubren todos los atributos deseados en lugar de tener un solo mAb con cobertura parcial del antígeno.
Con los flujos de trabajo de alto rendimiento, se puede estrechar el enfoque en un subconjunto de monoclones con el mayor rendimiento. A continuación, puede avanzar con los subconjuntos de mayor rango para ejecutar más evaluaciones en los estudios en animales y las pruebas de toxicología. También ahorraría tiempo eliminando subconjuntos no adecuados para purificaciones a gran escala, lo que evita el drenaje económico durante el viaje de búsqueda de la COVID-19 del laboratorio.
Automatización de los procesos de laboratorio mAb en el futuro
Muchos laboratorios de investigación de la COVID-19 ya han implementado procesos automáticos desde que pueden generar datos para miles de clones a la semana. La comprensión de los mecanismos terapéuticos de mAb es mucho más probable con la síntesis, expresión, purificación y tipificación biofísica automáticas.
Y lo que es más importante, la automatización allana el camino para los métodos de análisis y los criterios de selección no sesgados. El análisis objetivo es necesario para diversificar la biblioteca de anticuerpos para una amplia gama de variantes y mutaciones a fin de evitar el aumento de los anticuerpos que solo tratan un conjunto estrecho de variantes.
Futuro de la investigación del SARS-CoV-2 y el papel de los anticuerpos monoclonales
Los agentes terapéuticos basados en mAb han estado en el mercado de los Estados Unidos desde 1986 que con la primera aprobación de mAb por parte de la FDA del desarrollo de muromonab-CD3 (Orthoclone OKT3) para reducir el rechazo agudo en los pacientes con trasplante de vísceras. (1) La investigación actual sobre la COVID-19 también aumenta la importancia de los anticuerpos monoclonales en el diagnóstico. De hecho, los anticuerpos monoclonales jugaron un papel vital en la detección de las variantes del SARS-CoV-2.
Además del diagnóstico, los mAb actuales ayudan a los investigadores a determinar las modificaciones necesarias e incluso a informar sobre el desarrollo de los candidatos a la vacuna. Al investigar si un mAb de referencia puede neutralizar una variable de virus, los investigadores pueden decidir si desarrollar nuevos agentes terapéuticos más eficientes.
Si bien las vacunas a base de ARNm han sido el centro de la lucha contra la COVID-19, los anticuerpos monoclonales han estado detrás de las cámaras de varias aplicaciones, desde las vacunas a base de proteínas hasta los agentes terapéuticos a base de anticuerpos.
El Dr. Madasu y el Dr. Mitchell consideran que, en el futuro, podrían aplicarse anticuerpos monoclonales en particular a la población no vacunada, incluyendo a los recién nacidos, a los pacientes con comorbilidades (que no respondan bien a las vacunas) y a las personas que dudan en ser vacunadas. Como se ha mencionado anteriormente, la clave es producir productos terapéuticos basados en mAb asequibles y hacer que estén lo más ampliamente disponibles posible, aumentando la eficiencia en el proceso de detección y producción.
Descubrimiento de anticuerpos monoclonales para la COVID-19 con las soluciones de automatización de laboratorio de dispositivos moleculares
La detección de clones es uno de los cuellos de botella del descubrimiento de anticuerpos monoclonales porque tiene que probar y analizar miles de células con respecto al antígeno objetivo. Los flujos de trabajo de selección de clones automáticos pueden ayudar a superar esta carga reduciendo el tiempo de trabajo y unificando y estandarizando los datos extraídos de varios procesos.
Molecular Devices ha construido soluciones de flujo de trabajo integradas para los pasos esenciales. Los flujos de trabajo de desarrollo de líneas celulares automatizados tienen como objetivo producir líneas celulares monoclonales que produzcan niveles consistentes y suficientes de la proteína terapéutica objetivo. El flujo de trabajo automatizado de clonación molecular busca minimizar los errores y la contaminación durante el aislamiento de secuencias de ADN , que se propagan como vectores en la especie de su elección.
Estos flujos de trabajo optimizan el rendimiento de las proteínas objetivo a la vez que proporcionan una oportunidad para integrar otros instrumentos para una célula de trabajo totalmente automática con robótica. En general, dichos flujos de trabajo son rentables, ahorran tiempo y son fáciles de modificar con los cambios en los objetivos de la investigación.
En nuestra página Automatización de laboratorio para la selección de clones de alto rendimiento, puede Más información información sobre los flujos de trabajo de desarrollo de líneas celulares en mayor profundidad. No se pierda nuestra página de aplicación de anticuerpos monoclonales para ver los métodos de producción de mAb y las particularidades de cada paso implicado.
- Wang, S. S., Yan, Y. S. y Ho, K. ( 2021). Anticuerpos terapéuticos autorizados por la FDA de EE. UU. con fórmula de alta concentración: resúmenes y puntos de vista. Anticuerpos terapéuticos , 4(4), 262–272. https://doi.org/10.1093/abt/tbab027