
Aprovechando los ensayos de microplacas para el cribado optimizado de fármacos de alto rendimiento en la investigación del cáncer
Índice
- Cribado de alto rendimiento en la investigación del cáncer
- Ensayos de microplacas para la investigación del cáncer
- Descubra el potencial de los lectores de microplacas en la investigación del cáncer
Cribado de alto rendimiento en la investigación del cáncer
El cribado de alto rendimiento (HTS) ha revolucionado el campo de la investigación del cáncer al permitir la evaluación rápida y sistemática de los compuestos para su potencial como agentes antineoplásicos. Este enfoque representa un paso fundamental en las primeras etapas del descubrimiento de fármacos contra el cáncer.
HTS implica la evaluación metódica de miles a millones de compuestos de bibliotecas para identificar posibles candidatos que interactúan con objetivos biológicos específicos de una manera prevista. Estos candidatos, a menudo denominados “líderes” o “aciertos”, sirven como base para una mayor optimización y desarrollo de posibles agentes antineoplásicos.
Además, los recientes avances en el tratamiento personalizado del cáncer se han visto impulsados por el desarrollo de fármacos dirigidos. Estos tratamientos pueden aprovechar las innovaciones en tecnología de organoides, que implica el cultivo de organoides con capacidad de autorrenovación, autoorganización y proliferación a largo plazo, al tiempo que imitan muchas características de los tejidos primarios. Las bibliotecas de organoides derivados del paciente (DOP) han surgido como biobancos vivos, lo que permite análisis en profundidad de la función tisular, el desarrollo, el inicio del tumor y la patobiología del cáncer. Los PDO son versátiles y pueden utilizarse para análisis de secuenciación, cribado de fármacos, pruebas de terapia dirigida, estudios de microentorno tumoral y aplicaciones de ingeniería genética.
En el campo de la investigación del cáncer, estos instrumentos se emplean habitualmente para evaluar los efectos de los compuestos en las líneas celulares del cáncer, estudiar la expresión de genes o proteínas específicos y evaluar diversas respuestas celulares. Desempeñan un papel fundamental en la identificación de posibles agentes antineoplásicos y en el avance de nuestra comprensión de la biología del cáncer a través de esfuerzos sistemáticos de cribado a gran escala.
La robótica y los dispositivos de manipulación de líquidos son cruciales para la automatización de HTS. Estas tecnologías permiten la dispensación precisa de compuestos, células y reactivos en placas de múltiples pocillos, lo que garantiza la coherencia y minimiza el error humano.
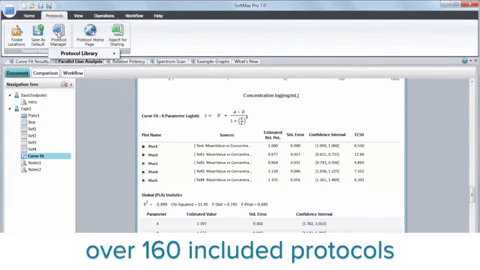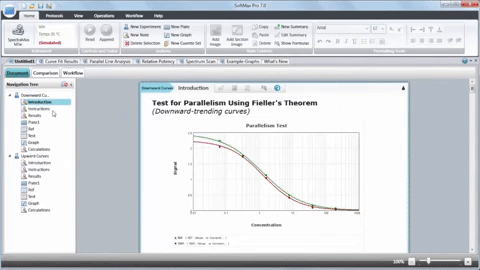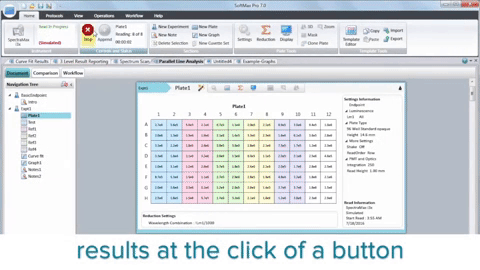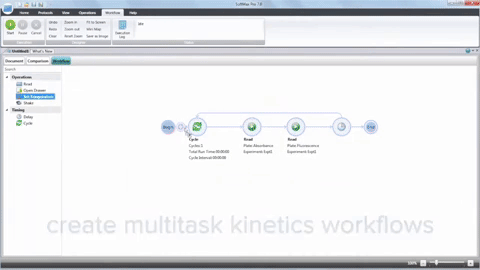
En resumen, la integración de lectores de microplacas, biología 3D, robótica, dispositivos de manipulación de líquidos y software dedicado ha revolucionado la investigación del cáncer al acelerar el descubrimiento de posibles compuestos antineoplásicos. Aunque HTS no sustituye todo el proceso de descubrimiento de fármacos, desempeña un papel fundamental en la identificación de clientes potenciales y mejora nuestra comprensión de la biología del cáncer.
Ensayos de microplacas para la investigación del cáncer
Los ensayos de microplacas han surgido como herramientas valiosas, ofreciendo capacidades de alto rendimiento y la capacidad de analizar numerosas muestras simultáneamente. Estos ensayos permiten a los investigadores investigar diversos aspectos de la biología del cáncer, desde la viabilidad celular y la citotoxicidad hasta las interacciones proteína-proteína y la actividad enzimática. En este artículo, exploraremos algunos de los ensayos de microplacas clave utilizados en la investigación del cáncer:
ensayos de viabilidad celular
Los ensayos de viabilidad celular se utilizan para determinar el número de células viables y proliferativas en una muestra. Son cruciales para evaluar el impacto de diferentes tratamientos en las células cancerosas, ayudando a los investigadores a evaluar el potencial de los agentes antineoplásicos. Los métodos comunes incluyen el uso de tintes que son absorbidos por células vivas, y la señal resultante se mide mediante un lector de microplacas.
- El ensayo MTT (bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio) se utiliza en gran medida en la investigación para evaluar la viabilidad y proliferación celular con lecturas colorimétricas. Las células metabólicamente activas reducen el colorante MTT amarillo para formar el producto de formazano morado (Figura 1). Esto se solubiliza y la intensidad de absorbancia se mide en un lector de microplacas a 590 nm. El TTM es bastante barato y relativamente rápido, ya que puede dar resultados en cuatro horas. En el mercado hay otros ensayos de microplacas que funcionan de forma similar, por ejemplo, XTT amarillo (2,3-bis-(2-metoxi-4-nitro-5-sulfofenil)-2H-tetrazolium-5-carboxanilide) se reduce mediante células metabólicamente activas a formol naranja (lectura de absorbancia, OD 450-500 nm) o colorante de resazurina (alamarBlue) se reduce a resorufina (lectura de fluorescencia, ex560/em 590).
Leer Nota de aplicación: Evalúe la proliferación y la viabilidad celular con lecturas colorimétricas

Figura 1. Esquema del mecanismo del ensayo MTT
- El ensayo de ATP (trifosfato de adenosina) es un ensayo de luminiscencia estable y homogéneo para determinar el número de células viables en cultivo. El método se basa en la cuantificación del ATP presente en el pocillo, un indicador de células metabólicamente activas (Figura 2). Varias empresas venden compuestos listos para usar que necesitan añadirse 1:1 en el pocillo con las muestras y, después de una incubación muy corta, la muestra se puede leer en un lector de microplacas equipado con el modo de detección de luminiscencia. Como se mencionó anteriormente, se realizan varias pruebas en la investigación del cáncer en modelos 3D. Realizar un ensayo de viabilidad en esferoides puede ser difícil debido a la dificultad de garantizar que el reactivo llegue al núcleo del esferoides. Sin embargo, ahora se dispone de ensayos de viabilidad basados en ATP específicos para cultivos 3D, lo que facilita la evaluación rápida de la respuesta al fármaco en sistemas de modelos 2D y 3D.
Obtenga más información sobre los ensayos de ATP:

Figura 2. Esquema del mecanismo del ensayo de luciferina basado en ATP
- El ensayo EarlyTox℮ Live/Dead de Molecular Devices contiene dos marcadores para células vivas o muertas: calceína AM y homodímero-III de etidio (EthD-III). La calceína AM no fluorescente atraviesa la membrana celular intacta y se convierte en calceína fluorescente por la acción de las esterasas intracelulares. EthD-III apenas es fluorescente y no puede atravesar una membrana plasmática intacta. Cuando la integridad de la membrana celular se ve comprometida (por muerte celular), EthD-III entra en las células y se une a los ácidos nucleicos, lo que da lugar a una fluorescencia de color rojo brillante en las células muertas (Figura 4).
Leer Nota de aplicación: Medición de la salud celular en el lector SpectraMax iD3 con ensayos de viabilidad celular
ensayos de citotoxicidad
En la investigación del cáncer es crucial comprender cómo responden las células a varios tratamientos, incluidos los posibles agentes antineoplásicos. Estos ensayos de microplacas pueden ayudar a los investigadores a diferenciar entre procesos apoptóticos (muerte celular programada) y necróticos (muerte celular no controlada).
- Se han diseñado diversos ensayos para detectar y medir diferentes procesos de muerte celular, incluidas la apoptosis y la necrosis. En uno de estos ensayos de Promega, la unión de dos proteínas de fusión de anexina V que contienen subunidades complementarias de NanoBiT® luciferasa a la fosfatidilserina expuesta en la valva exterior de las membranas celulares durante el proceso apoptótico permite la generación de una señal luminiscente. Tras la pérdida de integridad de la membrana, un colorante de unión al ADN entra en la célula y genera una señal fluorescente verde (Figura 3).

Figura 3. En las células sanas, las proteínas de fusión Annexin V-LgBiT y Annexin V-SmBiT (NanoBiT) están muy separadas y no se genera luminiscencia. El colorante de ADN profluorescente no se une al ADN, y la señal fluorescente también está ausente (A). En la apoptosis temprana, la luminiscencia permanece baja hasta que la exposición a PS une las proteínas de fusión de la anexina V, formando una luciferasa funcional, mientras que el colorante de ADN profluorescente permanece fuera de las células. Se genera luminiscencia y la fluorescencia permanece ausente (B). Durante la necrosis secundaria, la señal fluorescente se genera tras la pérdida de integridad de la membrana durante la apoptosis en fase tardía, cuando el colorante de ADN puede entrar en la célula. En este caso se generan tanto la luminiscencia como la fluorescencia (C).
- En el ensayo LDH (Lactate Dehydrogenase), la LDH se libera en el medio de cultivo celular cuando se interrumpen las membranas celulares, como en el caso de células muertas o moribundas.
- La actividad de la caspasa se mide utilizando un sustrato fluorogénico que emite fluorescencia tras la escisión por caspasas activas. Descubra el ensayo homogéneo de caspasa-3 de un solo paso diseñado específicamente para los lectores de microplacas: El sustrato fluorogénico (Ac-DEVD)2-R110 contiene dos secuencias diana consenso DEVD y es hidrolizado completamente en el lisado celular por las enzimas. La hidrólisis de ambos péptidos DEVD libera el colorante fluorescente verde R110, lo que origina un aumento considerable de la fluorescencia, con excitación a 110 nm y emisión a nm. Los kits de ensayo EarlyTox Caspase-3/7 NucView permite la detección de apoptosis en poblaciones de células intactas a través del uso del sustrato NucView Caspase-3. La ventaja de este ensayo de microplacas es que se ha optimizado para su uso tanto con lectores de microplacas como con sistemas de obtención de imágenes. Este kit de ensayo, utilizado junto con los lectores de microplacas SpectraMax o el citómetro de obtención de 300 imágenes SpectraMax MiniMax, proporciona a los usuarios un enfoque flexible para la cuantificación de la apoptosis. Las células apoptóticas pueden medirse directamente en función de la fluorescencia total por pocillo, o mediante la obtención de imágenes y el recuento de células individuales, con resultados comparables para ambos métodos. Por último, hemos demostrado que el 488 ensayo EarlyTox Caspase-3/7 NucView℮ también funciona muy bien con esferoides. Específicamente, evaluamos la apoptosis en esferoides HepG2 magnéticamente bioimpresos (Figura 4).

Figura 4. Esquema de diferentes opciones que se pueden buscar al realizar estudios de toxicidad con los kits de viabilidad celular EarlyTox .
Ensayos con gen indicador
Estos ensayos de microplacas implican la introducción de genes reporteros en el cáncer u otros tipos de células para monitorizar la actividad de genes específicos o vías de señalización. La expresión del gen indicador se puede cuantificar utilizando lectores de microplacas, lo que proporciona información sobre la regulación de los genes y las vías relacionados con el cáncer. Uno de los más utilizados es el ensayo indicador de luciferasa, que permite el estudio de la expresión génica a nivel transcripcional. Es popular porque es relativamente barato y ofrece mediciones rápidas y cuantitativas. La luciferasa de luciérnaga se utiliza ampliamente como indicador para estudiar la regulación y la función génicas. Es un indicador muy sensible debido a la falta de actividad luciferasa endógena en células de mamífero... La luciferasa de luciérnaga cataliza la oxidación dependiente de ATP de la D-luciferina con la emisión resultante de luz (Figura 1A). La luciferasa de la pansiosa Renilla reniformis marina se utiliza a menudo en ensayos de luciferasa multiplexada como segundo indicador para normalizar la eficiencia de la transfección y para estudiar la regulación y función génica. La luciferasa de Renilla cataliza la oxidación de la coelenteracina para producir luz. Los ensayos de luciferasa doble permiten medir tanto la actividad de la luciérnaga como de la luciferasa de Renilla en una sola muestra, actuando la luciérnaga como informador experimental y el control de Renilla (Figura 5).

Figura 5. Reacciones químicas catalizadas por luciferasa de luciérnaga (A) y luciferasa de Renilla (B).
El kit de ensayo SpectraMax® DuoLuc™ Reporter permite una cuantificación muy sensible de la luciferasa tanto de luciérnaga como de Renilla en células de mamífero. La inyección en serie de dos reactivos de detección optimizados permite analizar las luciferasas en el mismo pocillo de microplaca. Mostramos cómo se utilizan el ensayo DuoLuc Reporter y el lector SpectraMax iD5 para detectar la activación del factor nuclear κB (nuclear factor-κB, NF-κB) en un modelo de células de mamífero. La NF-κB es muy importante para la regulación de la inflamación, la inmunidad, la proliferación, la diferenciación y la apoptosis.
Más información sobre el ensayo con gen indicador de luciferasa:
- Monitorización de la activación de NF-κB con un ensayo sensible con gen indicador de luciferasa doble en SpectraMax iD5
- Detecte la expresión de luciferasa doble en el lector de microplacas FlexStation 3
Ensayos de actividad enzimática
Las enzimas, como las cinasas y las fosfatasas, desempeñan un papel crucial en las vías de señalización del cáncer. Los ensayos de actividad enzimática implican medir la actividad de estas enzimas utilizando sustratos que producen una señal detectable. Los lectores de microplacas cuantifican la reacción enzimática, lo que permite a los investigadores evaluar el impacto de diferentes tratamientos en la actividad enzimática.
- La tecnología IMAP® de Molecular Devices permite el ensayo rápido, homogéneo y no radioactivo de quinasas, fosfatasas y fosfodiesterasas y es adecuada tanto para el desarrollo de ensayos como para el cribado de alto rendimiento. Los ensayos IMAP se basan en la unión de la fosfatasa a nanopartículas o complejos de coordinación metálicos inmovilizados. Cuando las entidades de unión de IMAP se unen al sustrato fosforilado, el movimiento molecular del péptido se altera y la polarización de fluorescencia (PF) del marcaje fluorescente unido al péptido aumenta (figura 1, izquierda). En una versión TR-FRET del ensayo, la inclusión de un donador de terbio (Tb) permite que tenga lugar la transferencia de energía fluorescente cuando el sustrato fosforilado está presente (figura 1, derecha). Este ensayo se detecta en modo resuelto en el tiempo, lo que elimina prácticamente la interferencia de fluorescencia procedente de los componentes del ensayo o de los compuestos de un cribado. TR-FRET también ofrece flexibilidad en cuanto a tamaño y concentración del sustrato.
Más información sobre los ensayos IMAP:

Figura 6. Principio del ensayo de PDE IMAP PF y TR-FRET
- THUNDER℮ es una plataforma de ensayos basada en células versátil y rentable desarrollada por Bioauxilium Research para medir proteínas individuales fosforiladas y endógenas totales. Específicamente, el kit de ensayo de Phospho-ERK1/2 (T202/Y204) de THUNDER es un inmunoensayo sándwich homogéneo TR-FRET con un flujo de trabajo sencillo que consta de tres pasos que pueden informar indirectamente de la actividad mayor o menor del receptor de tirosina cinasa, ubicado aguas arriba de la vía de señalización celular MAPK/ERK (Figura 8).
Leer Nota de aplicación: Medición en células de la fosforilación de ERK1/2 con el ensayo THUNDER TR-FRET

Figura Inmunoensayo tipo sándwich 8 THUNDER TR-FRET. La unión de Eu-Ab1 y FR-Ab2 al analito permite la transferencia de energía del quelato de europio al fluoróforo aceptor, lo que da lugar a una señal a 665 nm que se detecta mediante un lector de microplacas con modo de detección con resolución temporal.
Ensayos de interacción proteína-proteína
Los investigadores utilizan lectores de microplacas para detectar y cuantificar las interacciones entre proteínas específicas en las vías del cáncer. Estas interacciones pueden revelar las funciones de estas proteínas en el desarrollo y la progresión del cáncer. Los tratamientos farmacológicos a menudo están diseñados con el objetivo de alterar cierta interacción proteína-proteína. Por lo tanto, es importante tener ensayos de microplacas que faciliten el estudio de las interacciones entre proteínas específicas.
- La transferencia de energía de resonancia de bioluminiscencia (BRET) es una técnica para medir interacciones proteína-proteína o proteína-ligando que implica la interacción de un donador bioluminiscente y un aceptor fluorescente. Cuando el donante y el aceptador están más cerca que 10 nm entre sí, el donante excita al aceptador, que luego emite fluorescencia. Al etiquetar una proteína de interés con el donante y su socio de unión con el aceptador, se pueden medir las interacciones de las proteínas utilizando un lector de microplacas para detectar la luz emitida por el donante y el aceptador (Figura 9).
Obtenga más información sobre la tecnología NanoBRET:

Figura 9. Ensayo NanoBRET. Cuando una fusión NanoLuc-Protein A (donante de energía) interactúa con una fusión HaloTag-Protein B marcada fluorescentemente (aceptador de energía), el donante y el aceptador se acercan y se transfiere energía.
- Hay disponible una gran variedad de reactivos y kits de caja de herramientas para abordar ensayos de receptores nucleares, interacciones proteína-proteína, dimerización de receptores, unión de ligando, internalización de receptores, ensayos enzimáticos, y muchos más. HTRF implica el uso de dos fluoróforos, un donador y un aceptor, para marcar proteínas u otras biomoléculas de interés. Cuando las biomoléculas interaccionan, su proximidad permite que se produzca la transferencia de energía de resonancia de fluorescencia (FRET) del fluoróforo donador al aceptor. El uso de criptatos de lantánidos fluorescentes de larga duración como donadores permite la detección resuelta en el tiempo de ensayos HTRF, minimizando la fluorescencia de fondo de corta duración procedente de los compuestos y otros materiales. La detección de la FRET resuelta en el tiempo (TR-FRET) con un lector de microplacas proporciona una lectura de la unión biomolecular. (Véase también IMAP TR-FRET, más arriba).
- La polarización de fluorescencia (PF) es una técnica muy utilizada para monitorizar eventos de unión en solución. Se puede utilizar para evaluar la unión proteína-anticuerpo, la hibridación del ADN, la actividad enzimática y es bien adecuado para el cribado de alto rendimiento. Una pequeña molécula marcada con fluorescencia (marcador) que se excita con luz polarizada en un único plano emite luz en su mayoría despolarizada, ya que el marcador gira rápidamente durante el tiempo transcurrido entre la excitación y la emisión. Sin embargo, cuando el marcador se une a una molécula mucho mayor, gira más lentamente, y la luz emitida sigue estando en gran medida polarizada. La cantidad de luz polarizada/despolarizada proporcionará una cuantificación de la interacción entre la proteína y el marcador. (Véase también IMAP FP, más arriba).
Leer Nota de aplicación: Creación y optimización de un ensayo de polarización de fluorescencia
ELISA (ensayo de inmunoadsorción ligado a enzima)
Los ELISA se utilizan ampliamente para la cuantificación de proteínas en la investigación del cáncer. Los lectores de microplacas miden las señales generadas en estos ensayos para determinar la concentración de proteínas específicas, como citocinas o factores de crecimiento, que a menudo son relevantes para la biología del cáncer
Obtenga más información sobre ELISA descargando nuestro libro electrónico, ELISA explicado: desde lo básico hasta la aplicación práctica.
AlphaScreen/AlphaLISA
AlphaLisa es un ensayo homogéneo basado en microesferas para estudiar interacciones moleculares en formato de microplaca. En comparación con los métodos ELISA tradicionales, que tienen varios pasos de lavado que pueden dañar las monocapas celulares y requieren mucho tiempo, AlphaLISA no requiere pasos de lavado, lo que minimiza la pérdida celular, lo que da como resultado resultados más rápidos y precisos.
Leer Nota de aplicación: Cribado AlphaLISA en la plataforma de detección Paradigm de microplacas multimodo SpectraMax
TR-FRET (incluido HTRF)
HTRF® es una tecnología versátil desarrollada por Cisbio para la detección de interacciones biomoleculares. HTRF®, una tecnología de ensayo desarrollada por Cisbio, combina FRET (transferencia de energía de resonancia de fluorescencia) estándar con la medición de fluorescencia resuelta en el tiempo, eliminando la fluorescencia de fondo de corta duración.
Leer Nota de aplicación: Ensayo de TNFα humano de HTRF en el lector de microplacas multimodo SpectraMax Paradigm
El ensayo utiliza fluoróforos donantes y aceptadores. Cuando el donante y el aceptador están lo suficientemente cerca entre sí, la excitación del donante por una fuente de energía (por ejemplo, una lámpara de destello) activa una transferencia de energía al aceptador, que a su vez emite fluorescencia específica a una longitud de onda dada. El HTRF también se utiliza ampliamente en sustitución del ELISA clásico, ya que proporciona una estrategia sencilla sin lavado para detectar y cuantificar proteínas en tan solo dos horas. Además, tiene un amplio rango detectable y es escalable con estabilidad de señal larga.
Leer Nota de aplicación: Normalización de los ensayos HTRF de citoquinas para la viabilidad celular
Especies reactivas del oxígeno (Reactive Oxygen Species, ROS)
Las ROS se asocian con el estrés oxidativo y el desarrollo de cáncer. Los lectores de microplacas pueden cuantificar los niveles de ROS, lo que ayuda a los investigadores a comprender el estado oxidativo de las células cancerosas y cómo puede contribuir a la progresión del cáncer.
Leer Nota de aplicación: Medición de especies reactivas del oxígeno con los lectores de microplacas SpectraMax
Análisis del ciclo celular
El análisis del ciclo celular es un estudio importante que suele ser necesario en la investigación del cáncer. Por lo general, se realiza mediante citometría de flujo. No obstante, el lector de microplacas multimodo SpectraMax® i3x equipado con el citómetro de obtención de 300 imágenes SpectraMax® MiniMax pueda utilizarse para obtener y analizar imágenes de esferoides FUCCI (indicador de ciclo celular basado en ubiquitinación fluorescente). Los esferoides del FUCCI se han desarrollado para estudiar la progresión del ciclo celular del cáncer, ya que permiten la identificación de células en varias fases del ciclo celular. La tecnología FUCCI se basa en la sobreexpresión de las proteínas dependientes del ciclo celular geminina y Cdt1, fusionadas respectivamente a un fluoróforo verde y a un fluoróforo rojo. Los niveles de Cdt1 y geminina fluctúan de forma diferencial a lo largo del ciclo celular: Los niveles de Cdt1 alcanzan su máximo en la fase G1, mientras que los niveles de geminina aumentan en las fases S, G2 y M tardías. Esto da como resultado que el núcleo de las células que expresan el FUCCI aparezca rojo en la fase G1 y verde en las fases S, G2 y M tardías (Figura 10). Aunque este ensayo no está indicado para las pruebas de HTS, es un ensayo de microplacas importante que puede implementarse una vez que se han seleccionado las derivaciones del compuesto para una caracterización más profunda y profunda.
Leer Nota de aplicación: Adquiera y analice imágenes de esferoides FUCCI en el citómetro SpectraMax MiniMax

Figura 10. Análisis del ciclo celular del FUCCI. Las proteínas del ciclo celular marcadas con fluorescencia de mCherry-Cdt y AmCyan-geminin se expresan o degradan durante diferentes fases del ciclo celular de manera que las células aparecen rojas durante la fase G1 y verdes durante las fases S, G2 y M. Las imágenes celulares pueden utilizarse para monitorizar el ciclo celular en diversas condiciones experimentales.
Descubra el potencial de los lectores de microplacas en la investigación del cáncer
A pesar de los avances significativos en la comprensión de la base molecular y celular del cáncer, todavía hay mucho que aprender sobre sus causas, progresión y posibles tratamientos.
Hemos diseñado este libro electrónico para ofrecer una visión general exhaustiva y detallada del papel de los lectores de microplacas en la investigación y el desarrollo del cáncer.
